高铁酸钾(K2FeO4)和二氧化氯(ClO2)都是高效水处理剂,其工业制备的反应原理分别为 2Fe(OH)3+3 KClO+4KOH=2K2FeO4+3KCl+5H2O
2KClO3+ Na2SO3 +H2SO4=2ClO2 + Na2SO4+ K2SO4+ H2O
下列说法中,正确的是( )
| A.上述两个反应中, KClO3做氧化剂,KClO 做还原剂 |
| B.ClO2做水处理剂原理和明矾相同 |
| C.K2FeO4用于杀菌后其还原产物还可用作净水剂 |
| D.制备等物质的量的K2FeO4和ClO2,转移的电子数之比为1 : 1 |
对于反应N2(g)+3H2(g)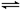 2NH3(g);△H<0,下列研究目的和示意图相符的是
2NH3(g);△H<0,下列研究目的和示意图相符的是
| A |
B |
C |
D |
|
| 目的 |
压强对反应的影响(P2>P1) |
温度对反应的影响 |
平衡体系增加N2对反应的影响 |
催化剂对反应的影响 |
| 图示 |
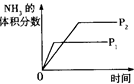 |
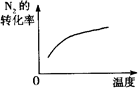 |
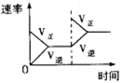 |
 |
已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol;
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol;
③H2(g)+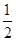 O2(g)===H2O(l)ΔH3=-285.8 kJ/mol。
O2(g)===H2O(l)ΔH3=-285.8 kJ/mol。
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的ΔH为( )
| A.-488.3 kJ/mol |
| B.-244.15 kJ/mol |
| C.+488.3 kJ/mol |
| D.+244.15 kJ/mol |
对可逆反应2A(s)+3B(g)  C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是()
C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是()
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
| A.①② | B.④ | C.③ | D.④⑤ |
在一定温度时,N2与H2反应过程中能量变化的曲线如右图所示。下列叙述正确的是( )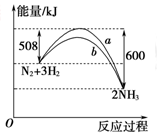
| A.该反应的热化学方程式:N2+3H2 = 2NH3 ΔH=-92 kJ/mol |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应放出的热量增多 |
| D.加入催化剂可增大正反应速率,降低逆反应速率 |
S2Cl2是广泛用于橡胶工业的硫化剂,常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,其结构与H2O2类似。下列说法错误的是( )
| A.S2Cl2分子中的两个S原子均是sp3杂化 |
| B.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl |
| C.S2Br2与S2Cl2结构相似,熔沸点S2Br2>S2Cl2 |
| D.S2Cl2分子中的S为+1价,是含有极性键和非极性键的非极性分子 |