高铁酸钾(K2FeO4)和二氧化氯(ClO2)都是高效水处理剂,其工业制备的反应原理分别为 2Fe(OH)3+3 KClO+4KOH=2K2FeO4+3KCl+5H2O
2KClO3+ Na2SO3 +H2SO4=2ClO2 + Na2SO4+ K2SO4+ H2O
下列说法中,正确的是( )
| A.上述两个反应中, KClO3做氧化剂,KClO 做还原剂 |
| B.ClO2做水处理剂原理和明矾相同 |
| C.K2FeO4用于杀菌后其还原产物还可用作净水剂 |
| D.制备等物质的量的K2FeO4和ClO2,转移的电子数之比为1 : 1 |
下列有关化学基本概念的判据正确的是
| A.氧化还原反应:元素化合价是否变化 | B.共价化合物:是否含有共价键 |
| C.强弱电解质:溶液的导电能力强弱 | D.胶体:是否有丁达尔效应 |
物质是由元素组成的,下列关于元素的说法不正确的是
A.构成地壳基本骨架的非金属元素是O、Si
B.蛋白质中均含C、H、O、N四种元素
C.水晶、陶瓷、玻璃的主要成分都是硅酸盐
D.元素的性质与原子核外电子数和原子核都有关系
往含0.2molKOH和0.1molCa(OH)2的溶液中持续地通入CO2气体,当通入气体的体积为6.72L(标准状况)时立即停止,则在这一过程中,溶液中离子的物质的量n和通入CO2的体积V的关系示意图正确的是(气体的溶解和离子的水解忽略)()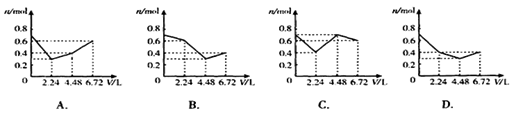
把铝粉与Fe3O4的混合物,分为两等份。前一份在高温下恰好完全反应,之后将生成物与足量盐酸充分反应;后一份直接加入足量NaOH溶液充分反应。前后两种情况下生成的气体在同温同压下的体积比是()
| A.4:3 | B.3:4 | C.9:8 | D.1:1 |
室温下,将一定质 量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至
量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至 沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是()
沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是()
| A.溶解合金时收集到NO气体的体积为2.24L |
B.参加反应的硝酸的物 质的量为0.1mol 质的量为0.1mol |
C.沉淀完全时消耗NaOH 溶液的体积为150mL 溶液的体积为150mL |
| D.加入合金的质量可能为6.4g |