下表为第2、3周期某些元素性质的数据。下列说法正确的是
| |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
原子半径/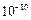 m m |
0.73 |
1.30 |
1.34 |
1.06 |
0.99 |
1.54 |
0.75 |
1.02 |
| 最高或最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
|
+6 |
| -2 |
|
|
|
|
|
-3 |
|
| A.③和⑤处于同一周期 | B.气态氢化物的稳定性④大于⑧ |
| C.上述八种元素最高价氧化物对应的水化物,⑤的酸性最强 | |
| D.①与⑥只能形成一种化合物 |
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是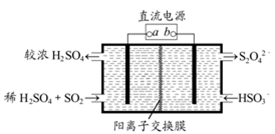
| A.a为直流电源的负极 |
| B.阴极的电极反应式为:2HSO3-+2H++e-=S2O42-+2H2O |
| C.阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+ |
| D.电解时,H+由阴极室通过阳离子交换膜到阳极室 |
(2014届江西省九江市七校高三第二次联考化学试卷)
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。下图为RFC工作原理示意图,有关说法正确的是()
A.当有0.1mol电子转移时,a极产生1.12L O2(标准状况下)
B.b极上发生的电极反应是:4H2O + 4e- = 2H2↑+ 4OH-
C.d极上发生的电极反应是:O2 + 4H+ + 4e- = 2H2O
D.c极上进行还原反应,B中的H+可以通过隔膜进入A
理综化学试卷)
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A.碳棒上发生的电极反应:4OH— -4e—=O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是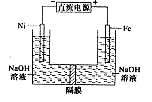
| A.铁是阳极,电极反应为Fe-6e一+4H2O=FeO42-+ 8H+ |
| B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计) |
下列是某校实验小组设计的一套原电池装置,下列有关描述不正确的是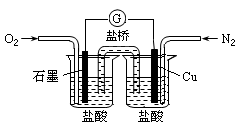
| A.此装置能将化学能转变为电能 |
| B.石墨电极的反应式:O2+2H2O+4e—=4OH— |
| C.电子由Cu电极经导线流向石墨电极 |
| D.电池总的反应是:2Cu+O2+4HCl=2CuCl2+2H2O |