(实验班做)室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是
A 0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液
B.0.2 mol/L的盐酸和0.1mol/L的氢氧化钡溶液
C.pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D.pH=4的盐酸和pH=l0的氨水
将 转变为
转变为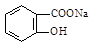 的方法为:
的方法为:
| A.与足量的NaOH溶液共热后,再通入CO2 |
| B.溶液加热,通入足量的HCl |
| C.与稀H2SO4共热后,加入足量的Na2CO3 |
| D.与稀H2SO4共热后,加入足量的NaOH |
下列物质的类别与所含官能团都正确的是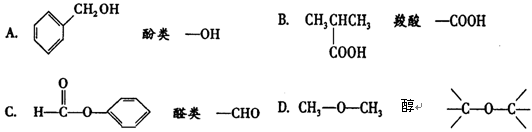
由2—氯丙烷制取1,2—丙二醇时,需要经过下列哪几步反应
| A.加成 → 消去 → 取代 | B.消去 → 加成 → 取代 |
| C.取代 → 消去 → 加成 | D.消去 → 加成 → 消去 |
下列关于有机物的命名中不正确的是:
| A.2─二甲基戊烷 | B.2─乙基戊烷 |
| C.3,4─二甲基辛烷 | D.3─甲基己烷 |
生活中的一些问题常涉及化学知识,下列叙述正确的是()
| A.蚕丝、棉花和人造丝的主要成分都是纤维素 |
| B.苯酚不小心沾到皮肤上,应立即用氢氧化钠稀溶液洗涤 |
| C.酒厂可用工业酒精勾兑白酒 |
| D.福尔马林是一种良好的杀菌剂,但是不能用来消毒饮用水 |