近来人们开发了通过电解同时生产NaOH和H2SO4的化学工艺,现在用离子交换膜(a、b)和石墨作电极的电解池进行生产模根,下列主产法中不正确的是( )
| A.阴极反应式4OH——4e-=2H2O+O2↑ |
| B.阴极得到NaOH4,阳极得到H2SO4 |
| C.每生产1molH2SO4,同时得到2mol NaOH |
| D.此反应实质就是电解水 |
下列说法正确的是:()
| A.信息产业中的光缆的主要成份是单质硅 |
| B.高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
| C.NOx、CO2、PM2.5颗粒都会导致酸雨 |
| D.煤经气化、液化和干馏三个物理变化过程,可变为清洁能源 |
Na2SO3溶液做为吸收液吸收SO2时,吸收液pH随n(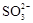 ): n(
): n(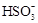 )变化的关系如下表:
)变化的关系如下表:
n(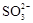 ): n( ): n(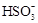 ) ) |
91:9 |
1:1 |
9:91 |
| pH |
8.2 |
7.2 |
6.2 |
以下离子浓度关系的判断正确的是
A.NaHSO3溶液中c(H+) < c (OH-)
B.Na2SO3溶液中c(Na+)> c (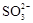 )> c (
)> c (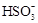 ) > c (OH-) > c(H+)
) > c (OH-) > c(H+)
C.当吸收液呈中性时,c(Na+) >c (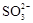 ) > c (
) > c (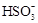 ) > c (OH-) = c(H+)
) > c (OH-) = c(H+)
D.当吸收液呈中性时,c(Na+)>c (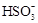 )+c (
)+c (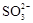 )
)
下列解释实验事实的方程式不正确的是
A.葡萄糖的酯化反应若用浓硫酸作催化剂会炭化发黑:C6H12O6(葡萄糖) 6C+6H2O 6C+6H2O |
| B.向AgNO3溶液中加入过量Na2S溶液后,再加NaCl稀溶液,黑色沉淀变成白色:Ag2S + 2Cl- =" 2AgCl↓+" S2- |
C.将NH3通入滴有酚酞的水中,溶液变红:NH3+ H2O  NH3·H2O NH3·H2O  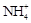 + OH- + OH- |
D.明矾的水溶液pH<7:Al3++ 3H2O  Al(OH)3(胶体)+3H+ Al(OH)3(胶体)+3H+ |
异秦皮啶具有镇静安神抗肿瘤功效,秦皮素具有抗痢疾杆菌功效。它们在一定条件下可发生转化,如图所示。有关说法正确的是
| A.异秦皮啶与秦皮素互为同系物 |
| B.异秦皮啶分子式为C11H12O5 |
| C.秦皮素一定条件下能发生加成反应、消去反应和取代反应 |
| D.1mol秦皮素最多可与2molBr2(浓溴水中的)、4molNaOH反应 |
下列图像表达正确的是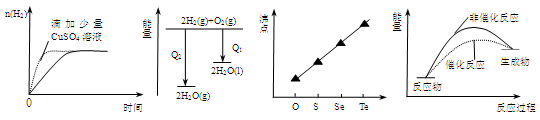
| A.等质量锌粉与足量盐酸反应 |
| B.氢气与氧气反应中的能量变化 |
| C.气态氢化物沸点 |
| D.催化反应与非催化反应过程中的能量关系 |