今年初爆发的农夫山泉与统一饮料的“砒霜门事件”引起了人们对砷的生理作用的关注。砒霜是砷的氧化物,化学式为As2O3,砷在周期表中与氢、磷属于同族元素。该族元素与生物体的生命活动密切相关。被称为“生命之族”。如氮、磷是生物体中不可缺少的元素,在生命体中占有板其重要的地位。而砷和锑的某些化合物则有毒,所以中世纪的西方炼金术上曾分别用毒蛇和狼来作为砷和锑的符号。
|
|
(1)砷的基态原子的价电子排布式是 。右上图是元素周期表的局部示意图,请将氮、磷、砷的元素的符号填入表中相应的位置。
(2)下列关于该元素的说法中正确的是 。葡萄糖是一种应用广泛的工业原料,由葡萄糖发酵得到的有机物A的分子结构模型如图所示
(1)当有机物分子中的碳原子通过四个单键与不同原子(或原子团)相连时,该碳原子为手性碳原子,则A中的手性碳原子有个。
(2)通过两种反应可以使A中的手性碳原子失去手性,写出反应的化学方程式。
①
②
(3)在一定条件下,两分子A能脱去两分子水形成一种六元环状化合物,写出该反应的方程式__________________________.
(4) A可以由丙烯经下列过程制得,E→B的反应类型为。C→D的反应类型为。
(5)酿酒工业上以葡萄糖为原料在酒化酶的作用下制得酒精。写出反应的化学方程式
Ⅰ某化合物结构简式如图,请根据所示的化合物回答问题: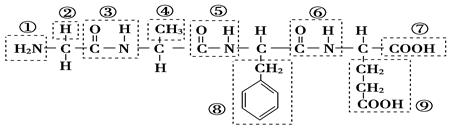
(1)该化合物中,官能团①的名称是________;官能团⑦的名称是________;该化合物是由________个氨基酸分子脱水形成的;
(2)写出该化合物水解生成的任意一种氨基酸与氢氧化钠溶液反应的化学方程式:_________________
Ⅱ食品安全关系着国民生计,影响食品安全的因素很多。
(3)聚偏二氯乙烯( )具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
)具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
(4)劣质植物油中的亚油酸[CH3(CH2)4—CH===CH—CH2—CH===CH—(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是________。(填序号)
| A.分子式为C18H34O2 |
| B.一定条件下能与甘油(丙三醇)发生酯化反应 |
| C.能和NaOH溶液反应 |
| D.能使酸性KMnO4溶液褪色 |
(5)假酒中甲醇(CH3OH)含量超标,请写出Na和甲醇反应的化学方程式:______________________。
(6)淀粉最终的水解产物是葡萄糖。请设计实验证明淀粉已经全部水解,写出操作、现象和结论:______________。
把6.5gZn放入足量盐酸中,Zn完全反应,计算生成H2的体积(标准状况)
用不含Fe3+ 的FeSO4 溶液与用不含O2的蒸馏水配制的Na溶液反应制备氢氧化亚铁。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入____________________
(2)除去蒸馏水中溶解的氧气常采用的方法是________________
(3)生成白色Fe(OH)2沉淀的操作使用长滴管吸取不含O2 的NaOH溶液,插入FeSO4溶液液面以下,再挤出NaOH溶液。这样操作的理由是___________________________________________________
A、B、C、D、E五种物质的焰色反应都显黄色,A、B与水反应都有气体放出,A与水反应放出的气体具有氧化性,同时都生成溶液C,C与适量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能变成D。写出A~E的化学式:A____________、
B____________、C____________、D______________、E______________。