A、B、C、D、E、F均为常见的短周期元素,原子序数依次增大,已知:
① A元素中的一种原子没有中子.
② B元素原子最外层电子数是次外层电子数的2倍.
③ C元素最高正价与最低负价的代数和为2.
④ A与D能以原子个数比1:1、2:1形成两种液态化合物.
⑤ E2+离子的电子层结构与氖原子相同.
⑥ F元素有多种化合价,且常温下F元素的单质与强碱溶液反应,可得到两种含F元素
的化合物.
⑦ C、F两种元素质子数之和是B元素质子数的4倍.
回答下列问题:
(1)A元素中没有中子的同位素的原子组成符号为 ,F简单阴离子的结构示意图 ,化合物AFD的电子式为 ,B2A2的结构式为 .
(2)由C、F两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里C、F两种原子最外层均达到8个电子的稳定结构.X遇水蒸气可形成一种常见的漂白性物质.则X的分子式 ;分子中C、F原子间的化学键的类型为 (填“极性键”或“非极性键”),属于 分子(填“极性”或“非极性”),X与水反应的化学方程式为 .
(3)B、C两种元素可形成一种硬度比金刚石还大的化合物Y.在化合物Y中,B、C两原子以单键相结合,且每个原子的最外层均达到8个电子的稳定结构.则Y的化学式为 ,Y的硬度比金刚石硬度大的原因是 .
今有三种化合物结构如下:
(1) 请写出丙中含氧官能团的名称:。
(2) 请判断上述哪些化合物互为同分异构体:___。
(3)写出化合物乙与小苏打溶液反应的化学方程式:。
具有水果香味的中性物质A可以发生下列变化:
(1) 推断下述物质的结构简式:
A:________________ B: ________________
C: ________________ D: ________________
(2) 写出下列变化的化学方程式,并注明化学反应类型:
G→高分子化合物:,反应类型。
某烯烃,经与氢气加成反应可得到结构简式为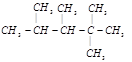
的烷烃,则此烯烃可能的结构简式是:___________、___________、___________。
(1)
为进行Ⅰ项中的除杂实验(括号内为杂质),请从Ⅱ项中选出一种试剂,从Ⅲ项中选出一合适的实验操作方法分离,将标号填在后面的答案栏内。
| Ⅰ 除杂实验 |
Ⅱ 试剂 |
Ⅲ 操作方法 |
答案 |
||
| Ⅰ |
Ⅱ |
Ⅲ |
|||
| ①苯(苯酚) |
A.饱和Na2CO3溶液 B.NaCl晶体 C.NaOH溶液 D.CaO |
a.蒸馏 b.分液 c.盐析、过滤 |
① |
||
| ②乙醇(水) |
② |
||||
| ③肥皂(甘油、水) |
③ |
||||
| ④乙酸乙酯(乙酸) |
④ |
(2)现有以下有机物:(用序号回答下列各问)
① 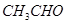 ②
② 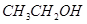 ③
③ 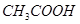 ④
④ 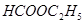
①能与 溶液反应的有_________________;
溶液反应的有_________________;
②能与银氨溶液反应产生银镜的是____________________;
③既能发生消去反应,又能发生酯化反应的有___________________;
④核磁共振氢谱图中有3个吸收峰,面积比为3:2:1的是___________;
(3)a.在洁净的试管中加入少量硝酸银溶液,再逐滴滴加稀氨水,现象是生成白色沉淀,反应的离子方程式是①_______________________ ;继续滴加至沉淀恰好溶解,即得银氨溶液;b. 向a中所得的银氨溶液中滴入少量葡萄糖溶液,混合均匀后,放在水浴中加热3min~5min,即可在试管内壁上形成银镜,则此反应的化学方程式为②(葡萄糖的结构简式用G-CHO表示):。
| A |
|||||||||||||||||
| B |
C |
||||||||||||||||
(1)元素A的名称是, 位于第周期,第族,原子结构示意图为。
(2)在我们常用的周期表中,氢元素的位置比较尴尬,它是第1列的唯一非金属元素。请写出H2O的电子式:,氢还能与许多金属形成金属氢化物比如NaH,试分析其中氢元素的化合价为,这样看来若把氢元素放在 族也有一定道理。
(3)元素B与元素C形成的化合物中,化学键类型为。
(4)A、B、C的原子半径由大到小的顺序为(用元素符号回答)。