将一定质量的镁和铝的混合物投入100 mL盐酸中,固体全部溶解后,向所得溶液中加入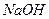 溶液,生成沉淀的物质的量与加入
溶液,生成沉淀的物质的量与加入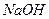 溶液的体积关系如下图所示。若不考虑金属和盐酸反应时
溶液的体积关系如下图所示。若不考虑金属和盐酸反应时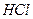 的发挥,则下列说法正确的是( )
的发挥,则下列说法正确的是( )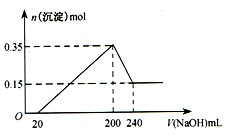
| A.镁和铝的总质量为9 g |
| B.盐酸的物质的量浓度为5mol·L-1 |
C.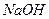 溶液的物质的量浓度为0.5mol·L-1 溶液的物质的量浓度为0.5mol·L-1 |
| D.生成的氢气在标准状况下的体积为11.2L |
有4种有机物:①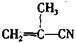 ②
②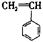 ③
③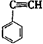 ④ CH3—CH=CH—CN,其中
④ CH3—CH=CH—CN,其中
 可用于合成结构简式为
可用于合成结构简式为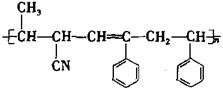 的高分子材料的正确组合为
的高分子材料的正确组合为
| A.①③④ | B.①②③ | C.①②④ | D.②③④ |
玻璃器皿上沾有一些用水洗不掉的残留物,其洗涤方法正确的是
①残留在试管内壁上的碘,用酒精洗涤②盛放过苯酚的试剂瓶中残留的苯酚,用酒精洗涤③做银镜反应后试管壁上银镜,用稀氨水洗涤④沾附在试管内壁上的油脂,用热碱液洗涤
| A.①③④ | B.②③④ | C.①②④ | D.①②③④ |
 下面四种变化中,有一种变化与其他三种变化类型不同的是:
下面四种变化中,有一种变化与其他三种变化类型不同的是:
A.CH3CH2OH + CH3COOH CH3COOCH2CH3 + H2O CH3COOCH2CH3 + H2O |
| B.CH2=CH2+H2O → CH3CH2OH |
C.2CH3CH2OH CH3CH2OCH2CH3 + H2O CH3CH2OCH2CH3 + H2O |
D.CH3CH2OH + HBr CH3CH2Br + H2O CH3CH2Br + H2O |
有关下图所示化合物的说法不正确的是


A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 |
B.1 mol 该化合物最多可以与3 mol NaOH反应 |
C.既可以催化加氢,又可以使酸性KMnO4溶液褪色 |
D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
现有三组混合液:(1)甲酸乙酯和乙酸钠;(2)乙醇和丁醇;(3)溴化钠和单质溴的水溶液,分离以上 各混合液的正确方法依此是
各混合液的正确方法依此是
| A.分液、萃取、蒸馏 | B.萃取、分液、蒸馏 |
| C.萃取、蒸馏、分液 | D.分液、蒸馏、萃取 |