锌和足量的稀HCl反应时,加入少量CuSO4固体,下列叙述正确的是:
| A.反应速率减慢,产生H2的量不变 |
| B.反应速率加快,产生H2的量不变 |
| C.反应速率不变,产生H2的量增加 |
| D.反应速率加快,产生H2的量减少 |
下列由相关实验现象所推出的结论正确的是
| A.铁在常温下不溶于浓硝酸,说明铁与浓硝酸不反应 |
| B.将氯气溶于水后溶液呈浅黄绿色,说明氯气与水没有完全反应 |
| C.将某气体通入品红溶液中溶液褪色,说明该气体一定是二氧化硫 |
| D.向溶液中滴加盐酸酸化的BaCl2溶液出现白色沉淀,说明该溶液中一定有SO42- |
化学与生活密切相关,下列说法错误的是
| A.航天服材质是由碳化硅/陶瓷和碳纤维等复合而成,具有耐高温防寒等性能 |
| B.从海水提取物质不一定都必须通过化学反应才能实现 |
| C.二氧化硅可用于制备太阳能电池板,晶体硅可用于制作光导纤维 |
| D.明矾可用于自来水的净化,氯气可用于自来水的杀菌消毒 |
根据表中信息,判断下列叙述中正确的是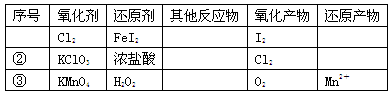
| A.表中①组的反应中氧化产物一定是I2 |
| B.氧化性强弱的比较:KClO3>Cl2>Fe3+>I2 |
| C.表中②组每生成1molCl2,转移1mol电子 |
| D.表中③组其他反应物可以为浓盐酸 |
在化学中有很多规律,下列对规律的应用正确的是
| A.根据较强酸可制取较弱酸的规律,可向次氯酸钠溶液中通入二氧化碳制取次氯酸 |
| B.根据金属与盐溶液混合发生置换反应的规律,可用钠置换出硫酸铜溶液中的铜 |
| C.根据酸性氧化物不与酸反应的规律,可用二氧化硅制成的容器盛放氢氟酸 |
| D.根据电荷守恒规律,可判断溶液中所含阳离子数目一定等于阴离子数目 |
下列物质与足量铁反应,转移电子数最少的是
| A.1mol氯气 | B.1mol S |
| C.含1molHNO3的稀硝酸 | D.含1molCuSO4的硫酸铜溶液 |