把a、b、c、d 四块金属片浸泡在盐酸中,用导线两两相连可以组成各种原电池:若a、b相连时,a为负极;c、d相连时,电子从 c流向d;a、c相连时,c极发生还原反应;b、d相连时,b极产生大量气泡。则这四种金属的活动性顺序由大到小为:
| A.a>b>c>d | B.b>d>c>a | C.c>a>b>d | D.a>c>d>b |
下列措施不合理的是
| A.久置不用的刀具涂抹凡士林后放于干燥处 |
| B.医用洒精的浓度越大,其杀菌效果越好 |
| C.高温下用焦炭还原SiO2制取粗硅 |
| D.用FeS做沉淀剂,除去废水中的Cu2+和Hg2+ |
对下列化学用语的理解和描述均正确的是
A.电子式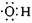 可以表示羟基.也可以表示氢氧根离子 可以表示羟基.也可以表示氢氧根离子 |
B.填充模型 可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 |
C.原子结构示意图 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
D.结构示意图为 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |
化学与人类生产、生活、社会可持续发展密切相关,下列说法不正确的是
| A.“天宫一号”中使用的碳纤维,是一种新型无机非金属材料 |
| B.为防止富脂食品氧化变质,常在包装袋中放入生石灰 |
| C.开发新能源,减少对化石燃料的依赖,可以促进低碳经济 |
| D.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 |
常温下,下列溶液中的微粒浓度关系正确的是
A.氯气通入氢氧化钠溶液中: |
B.pH=8.3的NaHCO3溶液: |
C.pH=11的氨水与pH=3的盐酸等体积混合: |
D.某溶液中只存在 四种离子,则可能存在: 四种离子,则可能存在: |
温度为T 时,向2.0 L恒容密闭容器中充入1.0 mol PC15,
反应: 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
经一段时间后达到平衡。反应过程中测定的部分数据见下表:
下列说法正确的是
A.反应在前50 S内的平均速率 mol/( mol/( ) ) |
B.保持其他条件不变,升高温度,平衡时 mol·L mol·L ,该反应为放热反应 ,该反应为放热反应 |
| C.相同温度下,起始时向容器中充入1.0 mol PC15、0.20 mol PC13和0.20 mo1 C12,达到平衡前的v(正)>v(逆) |
| D.相同温度下,起始时向容器中充入2.0 mol PC13、2.0 mol C12,达到平衡时,PCl3的转化率小于80% |