将标准状况下44.8 L NH3与足量的盐酸充分反应。试计算:
(1)生成NH4Cl的物质的量为多少?
(2)生成NH4Cl的质量为多少?
(14分)Ⅰ.恒温、恒压下,在一个可变容积的密闭容器中发生如下反应:
A(g)+B(g) C(g)
C(g)
(1)若开始时放入1 mol A和1 mol B,达到平衡后,生成a mol C,这时A的物质的量为____ mol。
(2)若开始时放入3 mol A和3 mol B,达到平衡后,生成C的物质的量为__________ mol。
(3)若开始时放入x mol A、2 mol B和1 mol C,达到平衡后,A和C的物质的量分别是y mol和3a mol,则x="__________" mol,y="__________" mol。平衡时,B的物质的量__________(选填一个编号)。
A.大于2 mol B.等于2 mol
C.小于2 mol D.可能大于、等于或小于2 mol
作出此判断的理由是__________。
(4)若在(3)的平衡混合物中再加入3 mol C,待再次达到平衡后,C的物质的量分数是_______。
Ⅱ.若维持温度不变,在一个与I反应前起始体积相同且容积固定的容器中发生上述反应。
(5)开始时放入1 mol A和1 mol B,达到平衡后生成b mol C,将b与(1)小题中的a进行比较____________(选填一个编号)。
A.a<b B.a>b C.a="b" D.不能比较a和b的大小
作出此判断的理由是________________________________________________________。
(12分)向20 mL HCl和H2SO4的混合溶液中逐滴加入0.1 mol·L-1的Ba(OH)2溶液,生成沉淀的质量和溶液的pH与加入的Ba(OH)2溶液体积的关系如图5所示。试完成下列问题: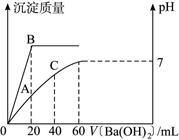
图5
(1)起始时,混合酸中硫酸的物质的量浓度为______________ mol·L-1。
(2)起始时,混合酸中盐酸的物质的量浓度为______________ mol·L-1。
(3)B点表示的沉淀的质量为______________g。
(4)A点表示溶液中的[H+]为______________ mol·L-1,pH为______________。
(5)C点的pH为______________(pH可直接用对数表示)。
某温度下,将一定量密度为1.15 g·cm-3的NaCl溶液用石墨电极通电电解,设NaCl恰好完全反应,且无其他反应发生,得到的溶液中氧元素的质量分数为80%。
(1)求电解后溶液中溶质与溶剂的物质的量之比。
(2)求原NaCl溶液的物质的量浓度。
在1青团L含0.001 mol·L-1 SO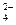 的溶液中,注入0.01 mol·L-1BaCl2,能否使SO
的溶液中,注入0.01 mol·L-1BaCl2,能否使SO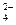 沉淀完全?〔已知Ksp(BaSO4)=1.08×10-10〕
沉淀完全?〔已知Ksp(BaSO4)=1.08×10-10〕
制备1 L含氨10%的氨水(密度是0.96 g· mL-1),需要标准状况下的氨气多少升?