下列解释实验事实的方程式不正确的是()
| A. | 溶液的 >1: |
| B. | " 球"浸泡在冷水中,颜色变浅 (红棕色)(无色) |
| C. | 铁溶于稀硝酸,溶液变黄: + ++ = ++ ↑+ |
| D. | 向 溶液中滴入酚酞溶液,溶液变红: |
下列图式表示正确的是
| A.氟化氢的电子式: H:F |
| B.铬元素外围电子排布是3d44S2 |
C.铝离子的结构示意图 |
D.氯化铯的晶体结构(晶胞)模型:  |
2011年3月11日日本地震损坏核电站设备,引起核泄漏。钚是核工业重要原料,原子核内质子数为94,有多种同位素如钚—238、钚—242、钚—244等,下列关于钚—238说法错误的是
| A.钚是f 区元素 | B..核外电子数238 |
| C.核内中子数 144 | D.钚是锕系元素 |
有①纤维素 ②环己烷 ③苯 ④乙酸。取等质量的上述有机物分别在过量氧气中完全燃烧,其中耗氧量由大到小排列顺序正确的是
| A. ①②③④ | B.②③①④ | C.④①③② | D.③④①② |
如图为某有机物的结构简式。关于该化合物的下列说法中,正确的是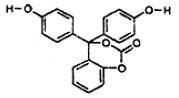
| A.该有机物1mol最多可以与4mol浓溴水发生加成反应 |
| B.该有机物的化学式为C20H16O5,该有机物可以看作酯类、酚类 |
| C.1mol该有机物能与10 mol氢气发生反应 |
| D.与足量氢氧化钠溶液充分反应,1mol该有机物最多可以与5molNaOH反应,所得产物中有醇类物质 |
可以把6种无色溶液:乙醇、苯酚、Na2CO3溶液、AgNO3溶液、KOH溶液、氢硫酸一一区分的试剂是
| A.新制碱性Cu(OH)2悬浊液 | B.FeCl3溶液 | C.BaCl2溶液 | D.酸性KMnO4溶液 |