铜锌原电池(如图所示)工作时,下列叙述正确的是:

| A. | 正极反应是: |
| B. | 电池反应是: |
| C. | 在外电路中电子从负极流向正极 |
| D. | 盐桥中的 移向 溶液 |
下列鉴别方法可行的是
| A.用氨水鉴别Al3+、Mg2+和Ag+ |
B.用盐酸酸化的BaCl2溶液鉴别Cl-、SO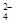 和CO 和CO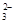 |
| C.用溴水鉴别CH4和C2H4 |
| D.用KMnO4酸性溶液鉴别CH3CH2OH和CH3CHO |
在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp (25℃)如下:
| AgCl |
AgI |
Ag2S |
|
| Ksp(单位省略) |
1.8×10-10 |
1.5×10-16 |
6.3×10-50 |
下列叙述错误的是
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀容易转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
硒(Se)与硫在元素周期表中位于同一主族。下列说法不正确的是
| A.原子半径:Se > S | B.沸点:H2S > H2Se |
| C.稳定性:H2S > H2Se | D.酸性:H2SO4 > H2SeO4 |
下列表示对应化学反应的离子方程式正确的是
| A.用白醋除铁锈:Fe2O3+6H+==3H2O+2Fe3+ |
B.向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热:Ba2++ 2OH-+NH+ HCO NH3↑+2H2O+BaCO3↓ NH3↑+2H2O+BaCO3↓ |
| C.AlCl3溶液中滴加浓氨水至过量:Al3++4NH3˙H2O ="=" AlO2-+4 NH4++2H2O |
| D.MnO2与浓盐酸反应制取Cl2:MnO2+4H++4Cl-== Mn2++2Cl2↑+2H2O |
下列用品的主要成分及用途对应不正确的是
| A |
B |
C |
D |
|
| 用品 |
 |
 |
 |
 |
| 成分 |
(NH4)2SO4 |
Na2CO3 |
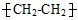 |
Fe2O3 |
| 用途 |
化肥 |
制玻璃 |
盛放食品 |
涂料 |