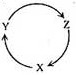
下表各组物质中,满足下图物质一步转化关系的选项是:

温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s |
0 |
50 |
150 |
250 |
350 |
| n(PCl3)/ mol |
0 |
0.16 |
0.19 |
0.20 |
0.20 |
下列说法正确的是
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的转化率大于80%
下列有关说法正确的是
| A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| B.醋酸钠溶液中滴加酚酞显红色,证明醋酸为弱电解质 |
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
| D.某温度下,纯水中的c(H+)=1.0×10-6.5mol/L,则该温度下pH=1的盐酸中水电离的c(H+)=1.0×10-12mol/L |
下列说法正确的是
| A.某反应的反应过程中能量变化如图所示,由上图分析可知催化剂不改变反应的焓变 |
| B.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
C.已知: 则可以计算出反应 则可以计算出反应 的ΔH为-384 kJ·mol-1 的ΔH为-384 kJ·mol-1 |
| D.常温下在0.10 mol·L-1的氨水中加入少量NH4Cl晶体,NH3·H2O的电离程度和溶液的pH均减小 |
室温下pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
| A.加适量的醋酸钾晶体后,两溶液的pH均增大 |
| B.使温度都升高20℃后,两溶液的pH均不变 |
| C.加水稀释100倍后,盐酸的pH增大幅度大 |
| D.加足量的锌充分反应后,两溶液中产生的氢气一样多 |
下列方程式书写正确的是
A.HCO3-在水溶液中的电离方程式:HCO3- +H2O H3O++CO32- H3O++CO32- |
B.H2SO3的电离方程式H2SO3 2H++SO32- 2H++SO32- |
C.CO32-的水解方程式:CO32- +2H2O H2CO3+2OH- H2CO3+2OH- |
D.CuSO4的水解方程式: Cu2++2H2O Cu(OH)2+2H+ Cu(OH)2+2H+ |