硫--碘循环分解水制氢主要涉及以下反应
I
Ⅱ
Ⅲ
(1)分析上述反应,下列判断正确的是
a.反应Ⅲ易在常温下进行 b.反应I中氧化性比强
c.循环过程中需补充 d.循环过程中产生1的同时产生1
(2)一定温度下,向1密闭容器中加入1 ,发生反应Ⅱ,物质的量随时间的变化如图所示。

0-2已见分晓的平均反应速率=,该温度下,的平衡常数=。
相同温度下,若开始加入的物质的量是原来的2倍,则是原来的2倍。
a.平衡常数 b.的平衡浓度 c.达到平衡的时间 d.平衡时的体积分数
(3)实验室用和稀硫酸制,反应时候溶液中水的电离平衡移动(填"向左"或"向右"或"不");若加入少量下列试剂中的,产生的速率将增大。
A. B. C. D.
(4)以为燃料可制作氢氧燃料电池。已知
某氢氧燃料电池释放228.8电能时,生成1液态水,该电池的能量转化率为。
有A、B、C三瓶失去标签的无色溶液:K2CO3、BaCl2、Na2SO4。首先不用其他试剂就可鉴别出的是 ,如要继续鉴别余下两种,还需要选用的试剂是 ,现象分别为 。
对于混合物的分离或提纯,常采用的方法有:①过滤、②蒸发、③蒸馏、④萃取、⑤加热分解等。下列各组混和物的分离或提纯应采用什么方法?(填序号)
(1)提取碘水中的碘 ___________;
(2)除去食盐溶液中的水 ___________;
(3)淡化海水 __________;
(4)KCl中含有KClO3 。
(每空2分,共16分)用某含泥沙、MgCl2、CaCl2、Na2SO4的粗盐为原料提取NaCl固体的工艺流程如下,请填空:
(1)若E主要为CaCO3、BaCO3和少量MgCO3沉淀,填写下列试剂的化学式:
① 、② 、③ 、④ ;
(2)写出C溶液中所含溶质成分的化学式:
C: 。
(3)写出加入下列试剂后所发生的化学反应方程式:
① ;
④ 、 。
物质的命名(共24分)
(1)系统命名法命名下列物质(每小题4分,共12分):
①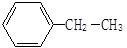 _________
_________
②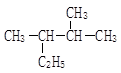 ___________
___________
③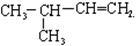 ________
________
(2)书写下列物质的结构简式(每小题4分,共12分):
①丙烷______________
②3,4-二甲基己烷______________
③间三甲苯_______________
过氧化氢(H2O2)的水溶液俗称双氧水,近年来倍受人们的青睐,被称为“绿色氧化剂”。
(1)写出H2O2的电子式 。
(2)你认为H2O2被称为“绿色氧化剂”的主要原因是 。
(3)将双氧水加入用盐酸酸化的FeCl2溶液中,溶液由浅绿色变为棕黄色,写出该反应的离子方程式为 ,反应中H2O2作 剂。
(4)双氧水能使酸性高锰酸钾溶液褪色,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里: MnO4﹣+ H2O2+ H+═ Mn2++ H2O+ 。