下列说法中正确的一组是 ( )
| A.H2和D2互为同位素; |
B. 和 和 互为同分异构体; 互为同分异构体; |
C.碳链为 与 与 的烃为同系物 的烃为同系物 |
| D.金刚石、石墨和“足球烯”C60为同素异形体 |
已知反应 ①
②稀溶液中, ,下列结论正确的是
,下列结论正确的是
| A.碳的燃烧热为110.5kJ/mol |
| B.2molC(s)+1molO2(g)的能量比2molCO(g)的能量高221kJ |
| C.0.5 molH2SO4(浓)与1 molNaOH溶液混合,产生57.3kJ热量 |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3kJ热量 |
下列盐既能发生水解反应,蒸干该盐溶液并充分加热后又能得到该盐(加热体系)的是
| A.Na2CO3 | B.AlCl3 | C.NaCl | D.NH4Cl |
下列说法中,正确的是
| A.某离子被沉淀完全是指该离子在溶液中的浓度变为0 |
| B.某物质的溶解性为难溶,则该物质的溶解度为0 |
| C.一般来说,溶解度小的难溶物容易转化为溶解度大的难溶物 |
| D.沉淀的生成、溶解和转化其实质都是沉淀发生了溶解平衡的移动 |
一定温度下,可逆反应 A2(g)+3B2(g)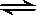 2AB3(g) 达到平衡的标志是
2AB3(g) 达到平衡的标志是
| A.容器内每减少1mol A2,同时生成2mol AB3 |
| B.容器内每减少1mol A2,同时生成3mol B2 |
| C.容器内A2、B2、AB3的物质的量之比为1:3:2 |
| D.容器内A2、B2、AB3的物质的量浓度相等 |
已知在某密闭容器中发生反应 4NH3+5O2=4NO+6H2O,若反应速率分别用
υ(NH3)、υ(O2)、υ(NO)、υ(H2O)表示,则下列关系正确的是
A.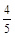 υ(NH3) =υ(O2) υ(NH3) =υ(O2) |
B. υ(O2) =υ(H2O) υ(O2) =υ(H2O) |
C. υ(NH3) =υ(H2O) υ(NH3) =υ(H2O) |
D.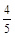 υ(O2) =υ(NO) υ(O2) =υ(NO) |