在2L容器中发生反应N2+3H2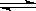 2NH3,经一段时间后NH3的物质的量增加了2.4 mol,这段时间内用氢气表示的反应速率为0.6mol /(L·s),则这段时间为
2NH3,经一段时间后NH3的物质的量增加了2.4 mol,这段时间内用氢气表示的反应速率为0.6mol /(L·s),则这段时间为
| A.6 s | B.4 s | C.3 s | D.2 s |
锌和铝都是活泼金属,其氢氧化物均能既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成配合物离子[Zn(NH3)4]2+。除去Al3+中的杂质Zn2+,最好的方法是:()
| A.加入适量的NaOH溶液,过滤洗涤,再加盐酸 |
| B.加入过量的NaOH溶液,过滤洗涤,再加盐酸 |
| C.加入适量的盐酸溶液,过滤洗涤再加NaOH溶液 |
| D.加入过量的氨水,过滤洗涤,再加盐酸 |
在[Co(NH3)6]3+中,与中心离子形成配位键的原子是()
| A.N原子 | B.H原子 | C.Co原子 | D.N、H两种原子同时 |
DNA分子的两条链之间通过氢键结合。DNA分子复制前首先将双链解开,则DNA分子复制将双链解开的过程可视为()
| A.化学变化 | B.物理变化 |
| C.既有物理变化又有化学变化 | D.是一种特殊的生物变化 |
邻羟基苯甲醛比对羟基苯甲醛熔、沸点低的原因是()
| A.邻羟基苯甲醛不形成氢键,而对羟基苯甲醛能够形成氢键。 |
| B.邻羟基苯甲醛形成分子内氢键,而对羟基苯甲醛能够形成分子间氢键。 |
| C.对羟基苯甲醛比邻羟基苯甲醛体积小,分子更紧凑。 |
| D.对羟基苯甲醛比邻羟基苯甲醛对称性高 |
科学家发现的C60是一种新的分子,它具有空心类足球的结构,被称为“足球分子”。最近科学家又确认存在着另一种“分子足球N60”,它与C60的结构相似,在高温或机械撞击时,其积蓄的巨大能量会在一瞬间释放出来。下列对于N60的说法中不正确的是()
| A.N60易溶于水 | B.N60是N2的一种同素异形体 |
| C.等物质的量分解吸收的热量N60>N2 | D.N60是共价键结合的空心球状结构 |