下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是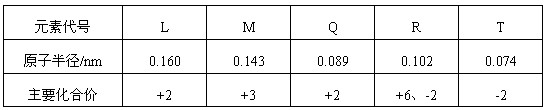
| A.L2+与R2-的核外电子数相等 |
| B.M与T形成的化合物具有两性 |
| C.氢化物的稳定性为H2T<H2R |
| D.单质与浓度相等的稀盐酸反应的速率为Q<L |
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1molS (s)转化为气态硫原子吸收能量280kJ,断裂1molF-F 、S-F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)=SF6(g)的反应热△H为
| A.-1780kJ/mol | B.-1220 kJ/mol |
| C.-450 kJ/mol | D.+430 kJ/mol |
0.02 mol/L HCN溶液与0.02 mol/L NaCN溶液等体积混合,已知混合溶液c(CN-)<c(Na+),则下列关系正确的是
| A.c(Na+)>c (CN-)>c(OH-)>c(H+) | B.c(HCN)+c(CN-)="0.04" mol/L |
| C.c(OH-)=c(H+)+c(HCN) | D.c(CN-)>c(HCN) |
下列溶液中微粒浓度关系一定正确的是
| A.室温时,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B.室温时,pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
| C.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) |
| D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
下列叙述不正确的是
| A.放电时负极反应为:Zn - 2e— + 2OH— ="=" Zn(OH)2 |
| B.充电时阳极反应为:Fe(OH)3 -3e— + 5OH— ="=" FeO42— + 4H2O |
| C.放电时每转移3moL电子,正极有1 mol K2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |
在t℃向一密闭容器中放入1mol A 和1 mol B发生反应:A(固) + B(气) C(气) + 2D(气),平衡时C的含量为m% ,保持温度不变,若按下列配比的物质放入容器中,达平衡时,C的含量仍为m%的是
C(气) + 2D(气),平衡时C的含量为m% ,保持温度不变,若按下列配比的物质放入容器中,达平衡时,C的含量仍为m%的是
| A.2molA和1molB | B.2molD和1mol A 和 1molB |
| C.1molC和2molD 和1molB | D.1molC和1molD |