铅蓄电池放电时发生下列变化:负极:Pb +SO42―-2 e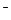 ="=" PbSO4↓
="=" PbSO4↓
正极:PbO2 + 4H+ + SO42―+ 2 e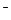 ==PbSO4↓+ 2H2O 使用该电池电解
==PbSO4↓+ 2H2O 使用该电池电解
CuSO4溶液,要得到纯铜1.6g,这时铅蓄电池消耗H2SO4的物质的量为
| A. 0.025mol | B.0.05mol | C.0.1mol | D.0.2mol |
下列热化学方程式中△H代表燃烧热的是
| A.CH4 ( g ) + 3/2O2 ( g ) = 2H2O ( l ) + CO ( g )△H1 |
| B.S ( s ) + 3/2O2 ( g ) = SO3 ( s )△H2 |
| C.C6H12O6 ( s ) + 6O2 ( g ) = 6CO2 (g) + 6H2O ( l )△H3 |
| D.2CO ( g ) + O2 ( g ) = 2CO2 ( g )△H4 |
加入正催化剂使反应速度加快,下列叙述不正确的是
| A.使反应体系的活化分子百分数增高 | B.使反应体系的活化分子总数增多 |
| C.使反应体系的活化分子百分数降低 | D.使反应体系的活化能降低 |
下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的△H=+566.0kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
通常用来衡量一个国家的石油化学工业发展水平的标志是()
| A.石油产量 | B.乙烯的产量 | C.合成纤维的产量 | D.硫酸的产量 |
对于反应2SO2(g)+O2(g) 2SO3(g),下列有关说法正确的是()
2SO3(g),下列有关说法正确的是()
| A.通入大量O2,V正增大,V逆减小 |
| B.2V正(SO2) =V逆(O2)时,反应达到平衡 |
| C.恒温恒容充入Ne,容器内压强增大,V正、V逆均不变 |
| D.V (SO2)∶V (O2)∶V (SO3) =2∶1∶2时,反应达到平衡 |