下列各物质中物质的量最多的是(NA表示阿伏伽德罗常数)
| A.1molCO2 | B.标准状况下44.8LH2 |
| C.3NA个水分子 | D.1L 1mol/L的碳酸钠溶液中含的溶质 |
在标准状况下,容积为1 L的密闭容器中刚好可以盛放a个N2分子和b个H2分子组成的混合气体,则阿伏加德罗常数的近似值可以表示为()
A.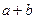 |
B.22.4(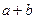 ) ) |
C.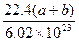 |
D.22.4(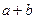 b)×6.02×10 b)×6.02×10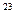 |
氧气和氮气组成的混合气体对氢气的相对密度可能是()
| A.12.5 | B.18.2 |
| C.16.1 | D.15.3 |
依照阿伏加德罗定律,下列叙述正确的是 …()
| A.同温、同压下,两种气体的体积之比等于摩尔质量之比 |
| B.同温、同压下,两种气体的物质的量之比等于密度之比 |
| C.同温、同压下,两种气体的摩尔质量之比等于密度之比 |
| D.同温同体积下,两种气体的物质的量之比等于压强之比 |
已知在3.2 g某气体中所含分子数目为3.01×10 ,由此可推知该气体的摩尔质量是 …()
,由此可推知该气体的摩尔质量是 …()
| A.64 g | B.32 g·mol |
C.32 g | D.64 g·mol |
一集气瓶质量为120 g,当其充满二氧化碳气体时共重124.4 g,若相同条件下改为充满一氧化碳气体,总质量为()
| A.122.8 g | B.121.2 g | C.124 g | D.126 g |