无水硫酸铜在加热条件下能发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气。某学生试图用下图所示装置来确定该化学反应中各物质的计量关系
试回答:


⑴加热过程中,试管A中发生的实验现象为 。
⑵装置E和F的作用是 ;
⑶该学生使用装置B的本意是除去混合气体中的三氧化硫以提纯氧气,他的做法正确
吗?为什么?
⑷该学生利用上述装置将一定质量的无水硫酸铜置于A中加热使其分解,最后测得氧
气的体积偏小,其原因可能是 (填序号)
| A.无水硫酸铜未完全分解 |
| B.实验结束时装置A中残留有气体 |
C.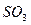 被 被 溶液吸收时产生了 溶液吸收时产生了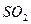 气体 气体 |
| D.最后读量筒中的读数时,E中的液面低于F中的液面 |
⑸另一学生将4.8g无水硫酸铜充分加热使其完全分解后,用正确的实验方法除去了生成物中的二氧化硫和三氧化硫,最后测出氧气的体积为224mL(标准状况)。据此可计算出二氧化硫为 mol,三氧化硫为 mol。
⑹由上述实验数据可知无水硫酸铜受热分解的化学方程式为:


___________________________________________________________________
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如下图所示。
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)________。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为________________________________________________________________________;
与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)________;
| A.Ⅳ比Ⅲ复杂 |
| B.Ⅳ比Ⅲ安全 |
| C.Ⅳ比Ⅲ操作简便 |
| D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行 |
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是(填化学式)________。
有下列化学仪器:①托盘天平,②玻璃棒,③药匙,④烧杯,⑤量筒,⑥容量瓶,⑦胶头滴管,⑧细口试剂瓶,⑨标签纸。
(1)现要配制500 mL、1 mol·L-1的硫酸溶液,需用质量分数为98%、密度为1. 84 g·cm-3的浓硫酸__________________mL。
(2)从上述仪器及标签纸中,按实验使用的先后顺序,其编号排列是___________
(3)容量瓶在使用前需要检验_____________。
(4)下列操作对硫酸的物质的量浓度有何影响(填“偏高”、“偏低”、“不变”)。
摇匀后发现液面低于刻度线再加水:_________容量瓶中原有少量蒸馏水:_______。
定容时俯视观察液面:___________
现有三组溶液:①汽油和水溶液②39%的酒精溶液⑧氯化钠和硝酸钾的水溶液,分离以上各混合液的正确方法依次是_________、___________、______________(填“过滤”、“萃取”、“分液”、“蒸馏”、“结晶”等)。
现有一定量含有Na2O杂质的Na2O2试样,用图K2-6-2所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水) 回答下列问题:
回答下列问题:
(1)装置A中液体试剂选用____________,理由是________________________________。
(2)装置B的作用是___________________________________________,装置E中碱石灰的作用是______________________________________________________________________。
(3)装置D中发生反应的化学方程式是_________________________________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为_________________。
已知稀溴水和氯化铁溶液都呈黄色。现在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液呈黄色,现对溶液呈黄色的原因进行探究。
(1)限选用的试剂有:酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液、硝酸银溶液、淀粉—碘化钾溶液。请完成以下实验探究过程:
【提出假设】
假设1:溶液呈黄色不是发生化学反应所致,是溶液中引起的(填微粒的化学式,下同)。
假设2:溶液呈黄色是发生化学反应所致,是溶液中引起的。
【设计实验方案】
为了验证上述假设1和假设2的推断,请用简要的文字说明你的实验方案:
假设1方案:。
假设2方案:。
(2)若向稀溴化亚铁溶液中通入过量氯气,反应的离子方程式为。
附加题:(实验班同学必做)