[化学——物质结构与性质]
已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子。请回答下列问题:
(1)E元素基态原子的电子排布式为 。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为 (填元素符号)。
(3)D元素与氟元素相比,电负性:D F(填“>”、“=”或“<”)。
(4)BD2在高温高压下所形成的晶体其晶胞如图所示。该晶体的类型属于 (选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为 。l mol B2A2分子中含 键的数目是 。
键的数目是 。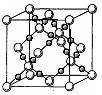
(5)光谱证实单质E与强碱溶液反应有[E(OH)4]—生成,则[E(OH)4]—中存在 。
a.共价键 b.配位键 c.σ键 d.π键
写出下列有机物的结构简式或名称:
⑴ 间甲基苯乙烯,⑵苯甲酸乙酯,
⑶ ,⑷
,⑷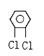 。
。
(5)命名下图所示有机物:__________________;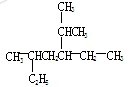
(6)若(5)中有机物是某单炔烃经过加成反应得到的,请写出此炔烃可能的结构简式__________________;
(11分) 已知有机物A不能发生银镜反应,也不能使溴水褪色;在一定条件下,A的苯环上发生卤代反应时只能产生两种一卤代物;A在一定条件下还能发生如下图所示的反应。B与过量的银氨溶液能发生银镜反应;C中具有八元环结构;D溶液中加入浓硝酸会变黄色;E能使溴水褪色。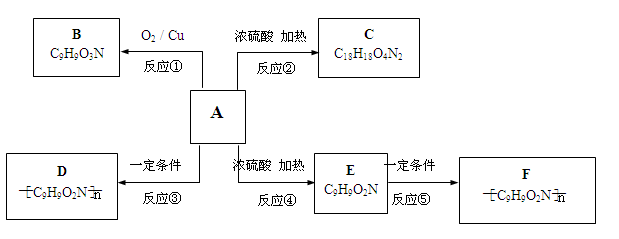
请回答:
(1)写出A的化学式:_______________;
AD的反应类型:;EF的反应类型:;
(2)写出下列变化的化学方程式: AC:;
EF:;
(3)写出D的结构简式: ____________ ;
(4)B发生银镜反应的离子方程式______________________;
(5)若E中的苯环和各官能团均保持不变,苯环上取代基的数目、位
置也不改变。写出符合上述条件的E的同分异构体有种。
某有机物A的分子式为C6H10Br2,不能使溴水褪色,G的分子式为C4H8,能使溴水褪色,A、G的核磁共振氢谱如下。G为石油化工基本原料,K为高分子化合物,1mol J与足量金属钠反应生成22.4L(标准状况)氢气,C、D互为同分异构体。各有机物之间的转化关系如下:
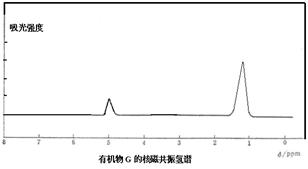
已知: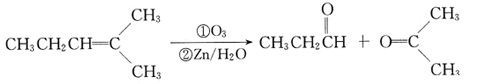
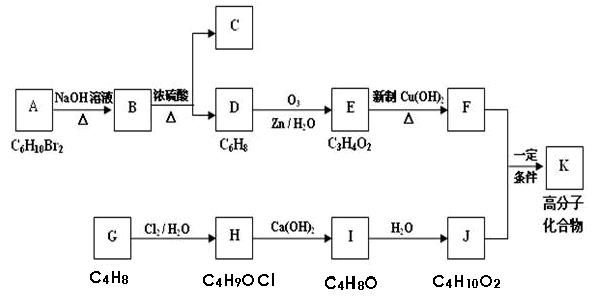
回答下列问题:
(1)C的结构简式为,
(2)写出B→D的化学方程式。
(3)A在一定条件下也能直接反应生成D,写出相应的化学方程式(需注明反应条件)
(4)写出F和J反应生成K的化学方程式
(5)有机物R与B互为同分异构体,满足下列条件的R共有种,写出任意的两种
①与NaOH溶液反应②不能与NaHCO3溶液反应③碳链无支链
用l-丁醇、溴化钠和过量较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物。现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出。请根据实验步骤,回答下列问题:
⑴关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。竖直冷凝管的作用是,写出该反应的化学方程式。
⑵理论上,上述反应的生成物还可能有:丁醚、1-丁烯、溴化氢、硫酸氢钠、水等。熄灭A处酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。B、C中应盛放的试剂分别是、。
(3)相关有机物的数据如下:
为了进一步精制1-溴丁烷,继续进行了如下实验:待烧瓶冷却后,拔去竖直的冷凝管,塞上带温度计的橡皮塞,关闭a,打开b,接通冷凝管的冷凝水,使冷水从(填c或d)处流入,迅速升高温度至℃,收集所得馏分。
(4)若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g 1-溴丁烷,则1-溴丁烷的产率是。
Ⅰ:在H2O2作用下可实现Fe(CN)63-与Fe(CN)64-之间的相互转化,在酸性溶液中H2O2可使Fe(CN)64-转化为Fe(CN)63-;在碱性溶液里H2O2可使Fe(CN)63-转化为Fe(CN)64-。写出以上相互转化的离子方程式。
①酸性溶液中:,
②碱性溶液中:。
Ⅱ:膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。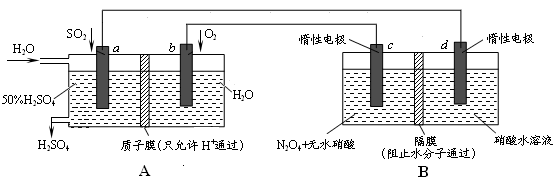
(3)A装置是________,B装置是_________(填“原电池”或“电解池”)。
(4)N2O5在装置中的______区(填“正、负极”或“阴、阳极”)生成,其电极反应式为______________。
(5)通入O2一极的电极反应式为_______________________________。