工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体: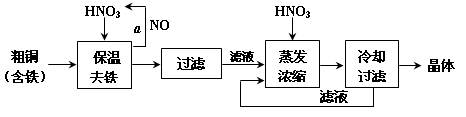
(1)在步骤a中,还需要通入氧气和水,发生反应的化学方程式是
。
(2)在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。若调节溶液的pH=4,此时,溶液中c (Fe3+) = 。[已知该条件下,Fe(OH)3的KSP= 4.0×10-36 ]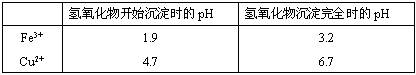
(3)不用加水的方法调节溶液pH的原因是 。
(4)进行蒸发浓缩时,要加适量的硝酸以保持溶液一定的c(H+),其目的是(结合离子方程式简要说明) 。
(5)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是 。
今有相对分子质量为M的有机物,燃烧后只生成二氧化碳和水。
①若有机物是M=72的烃,请写出所有可能的结构简式:_________;_________;_________。
②若M=58,且1mol该有机物与足量的银氨溶液作用,可析出4molAg, 则其结构简式为:_________________
则其结构简式为:_________________
③若A是分子 式为C12H16的烃,B是含4个氧原子的烃的含氧衍生物,A、B相对分子质量相等,则B的分子式可能为:______________________。
式为C12H16的烃,B是含4个氧原子的烃的含氧衍生物,A、B相对分子质量相等,则B的分子式可能为:______________________。
中国食疗网发布“反式脂肪酸预警报告”,报告称:脂肪酸分为顺式脂肪酸、反式脂肪酸两种,摄入过多的反式脂肪酸,容易堵塞血管而导致心脑血管疾病。两种脂肪酸的结构如图所示。试回答下列问题:
(1)脂肪酸中所含官能团的名称是_______________________________。
(2)上述“A”、“B”结构能表示“反式脂肪酸”的是(填“A”或“B”)
(3)上述顺(反)式脂肪酸都能与H2在一定条件下发生氢化反应,其产物关系为 。
。
| A.同分异构体 | B.同系物 | C.同一种物质 | D.对映异构体 |
(4)CH2 =CHCH2OH发生加成聚合反应后,所得产物的结构简式为______________
=CHCH2OH发生加成聚合反应后,所得产物的结构简式为______________
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子 Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过分析,认为无需 检验就可判断其中必有的两种物质是和(填化学式)。
检验就可判断其中必有的两种物质是和(填化学式)。
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质记C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时也产生红褐色沉淀,向该沉淀中滴人稀硝酸沉淀部分溶解,最后留有白色沉淀不再溶解。则X为。
A.SO32-B.SO42-C.CH3COO- D.SiO32-
(3)B的水溶液显性,原因为。(用离子方程式表示)
(4)将0.02 molA与0.0 1molC同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的物质的量为 (保留一位小数)
(保留一位小数)
(5)将Cu投人到装有D溶液的试管中,Cu不溶解;再 滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的
滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的 (填相应的离子符号)。有关反应的离
(填相应的离子符号)。有关反应的离 子方程式为:。
子方程式为:。
(6)利用上述已经确定的物质,可以检验出D、E中的阳离子。请简述实验操作步骤、现象及结论。
(18)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)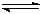 CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。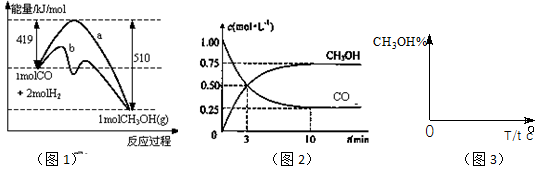
请回答下列问题:
(1)在“图1”中,曲线(填:a或b)表示使用了催化剂;该反应属于(填:吸热、放热)反应。
(2)下列说法正确的是
A.起始充入的CO为2mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不 变,再充入1molCO和2molH2,再次达到平衡时
变,再充入1molCO和2molH2,再次达到平衡时
n(CH3OH)/n(CO)会减小
(3)从 反应开始到建成平衡, v(H2)=________;已知:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数,那么在该温度下CO(g)+2H2(g)
反应开始到建成平衡, v(H2)=________;已知:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数,那么在该温度下CO(g)+2H2(g)  CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____
CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____ (填“增大”、“减小”或“不变”)。
(填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(5) 有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式。
有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D 最外层电子数之比为2:3。试回答下列问题:
(1)A元素的名称是,E元素在周期表中的位置是;
(2)C、D、F的气 态氢化物稳定性由强到弱的顺序是(填化学式);
态氢化物稳定性由强到弱的顺序是(填化学式);
(3)E单质在足量D单质中燃烧生成的化合物的电子式是;
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于晶体;
②X与Y的水溶液相混合发生反应的离子方程式为;
(5)向化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式为: ;
;
(6)若由A、 C组成的简单氢化物燃烧生成无污染物,燃烧热为aKJ/mol,请写出表示该简单氢化物燃烧热的热化学方程式。