铝制器皿能够盛放的物质是( )
| A.稀硝酸 | B.浓硫酸 | C.NaOH溶液 | D.稀硫酸 |
现有E、F、G、M、N五种可溶的强电解质,它们在水中电离产生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 |
OH-、Cl-、CO32-、NO3-、SO42- |
已知:①E、F两溶液呈碱性;G、M、N 溶液呈酸性。
②向N溶液中逐滴滴加F溶液至过量,沉淀量先增加后减少但不消失。
③M溶液与另外四种溶液反应都能产生沉淀。
下列说法正确的是()
A.N溶液与过量的F溶液反应的离子方程式为: Ba2+ + SO42- = BaSO4↓
B.E溶液与N溶液混合发生反应的离子方程式为:2Al3+ + 3CO32- + 3H2O = 2Al(OH)3↓+ 3CO2↑
C.M溶液与F溶液混合产生的沉淀不能溶解于过量氨水中
D.将G溶液逐滴加入等体积、等物质的量的浓度的E溶液中,反应的离子方程式为
2H+ + CO32- = CO2↑+ H2O
某溶液中含有HCO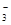 、SO
、SO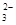 、CO
、CO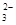 、CH3COO- 4种阴离子。向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)()
、CH3COO- 4种阴离子。向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)()
| A.CH3COO- | B.SO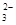 |
C.CO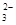 |
D.HCO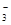 |
设NA为阿伏加德罗常数的数值,下列叙述正确的是()
| A.1.0L1.0 mo1·L-1的NaAlO2水溶液中含有的氧原子数为2 NA |
| B.常温下,30 g SiO2晶体中含有Si-O键的数目为NA |
| C.标准状况下,2.24 LCl2与足量水反应转移的电子数为0.2NA |
| D.V L a mol·L-1的氯化铁溶液中,若Fe3+的数目为NA,则Cl—的数目大于3NA |
氢化亚铜(CuH)是一种不稳定的物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可生成CuH。下列叙述中错误的是()
| A.“某物质”具有还原性 |
| B.CuH与盐酸反应可能产生H2 |
| C.CuH与足量稀硝酸反应:CuH+3H++NO3-=Cu2++NO↑+2H2O |
| D.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl |
海水资源的综合利用十分重要,不需要通过化学变化就能够从海水中获得的物质是( )
| A.食盐、淡水 | B.钠、镁 | C.烧碱、氯气 | D.溴、碘 |