黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
Ⅰ、将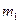 g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:
g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为: 。
。
Ⅱ、反应结束后,将乙瓶中的溶液进行如图2所示处理。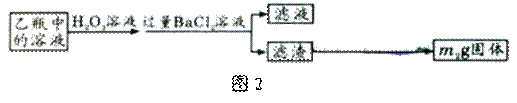
[实验二]测定铁元素的含量。
Ⅲ、测定铁元素含量的实验步骤如图3所示。
问题讨论:
(1)Ⅰ中,甲瓶内所盛试剂是 溶液。乙瓶内发生反应的离子方程式有: 、 。
(2)Ⅱ中的滤渣在称量前还应进行的操作是 。
(3)Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是 。
(4)Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有 。
④中取稀释液25.00ml需用的仪器是 。
(5)该黄铁矿中硫元素的质量分数为 。
实验室里需要纯净的溶液,但现在只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
根据以上设计方案,回答下列问题:
(1)操作①和⑤的方法分别是 、 ;
(2)操作②是否可改为加硝酸钡溶液?为什么? ,(填是或否)理由: 。
(3)操作②后,如何判断SO42-已除尽,方法是 。
(4)操作③的目的是 ;
(5)操作④加的试剂是 ;发生反应的离子方程式为: 。
右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为 mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取溶液体积的多少而变化的是 。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.3 mol/L稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②配制过程中,需要使用的仪器除了烧杯,玻璃棒,还包括 。
③在配制过程中下列实验操作会使所配制的稀盐酸的物质的量浓度偏高的是 。
A.用量筒量取浓盐酸后用蒸馏水洗涤量筒,并把洗涤液转移入容量瓶中
B.配制过程动作过慢,浓盐酸中HCl挥发
C.溶液注入容量瓶前没有恢复到室温就进行定容
D.定容时俯视刻度线
E.定容时仰视刻度线
F.定容时不小心加水超过刻度线,立即用胶头滴管吸出使凹液面最低点与刻度线相切
现用物质的量浓度为a mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是________________。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入________(填“甲”或“乙”)中。
(3)如图是碱式滴定管中液面在滴定前后的读数,c(HCl)________mol·L-1。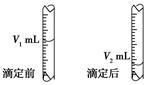
下图是实验室制取Cl2并以Cl2为原料进行特定反应的实验:
(1)A为氯气发生装置,写出反应的化学方程式________________________。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl,写出D装置中反应的化学方程式 _____;装置C的作用是 。
(3)E处石蕊试液的现象是_______________;
(4)若将E处溶液改为石灰水,反应过程的现象是_____________________________。
A.有白色沉淀生成 B.无白色沉淀生成 C.先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是________________,B的作用是________________。
某化学小组欲以CO2主要为原料,采用下图所示装置模拟“侯氏制碱法”制取NaHCO3,并对CO2与NaOH的反应进行探究。请你参与并完成对有关问题的解答。
【资料获悉】
1、“侯氏制碱法”原理:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,然后再将NaHCO3制成Na2CO3。
2、Na2CO3与盐酸反应是分步进行:Na2CO3先与盐酸反应生成NaHCO3;然后再发生NaHCO3+HCl=NaCl+H2O +CO2↑
【实验设计】
【实验探究】
(1)装置乙的作用是 。
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有 、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为 。
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如下图所示。
则曲线c对应的溶液中的离子是 (填离子符号);该样品中NaHCO3和Na2CO3的物质的量之比是 。
(4)若将装置甲产生的纯净的CO22.24L(标准状况下)通入100mLNaOH溶液中,充分反应后,将溶液小心蒸干,得到不含结晶水的固体W,其质量为10.16g,则W的成分为 (填化学式),原NaOH溶液的物质的量浓度为 。