某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2─、MnO4─、CO32─、SO42─中的若干种组成。取该溶液进行如下实验:⑴取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液;⑵ 在⑴所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;⑶ 在⑵所得溶液中加入过量Ba(OH)2溶液也有气体生成,同时析出白色沉淀乙。则下列离子在原溶液中一定存在的有
| A.SO42-、AlO2─、Na+ | B.CO32─、Na+、Al3+ |
| C.Na+、CO32─、AlO2─ | D.MnO4─、Na+、CO32─ |
电子云是用( )对核外电子运动规律所作的一种描述。
| A.归纳的方法 | B.统计的方法 |
| C.照相法 | D.叠加法 |
物质分类的依据通常是根据它的组成和性质,下列物质分类中,只考虑组成的是
| A.硫酸钠是钠盐、硫酸盐、正盐 |
| B.二氧化硫是氧化物、酸酐、有漂白性物质 |
| C.氢氧化钠是一元碱、易溶性碱、强碱 |
| D.碳酸氢钠是钠盐、酸式盐、易分解的盐 |
下列说法不正确的是
| A.大气污染物主要来自化石燃料和工业生产过程产生的废气 |
| B.形成酸雨的主要物质是硫氧化物和氮氧化物(NOx) |
| C.绿色化学的核心就是在生产过程中减少污染 |
| D.水华、赤潮等水体污染是由于含氮、磷的大量污水任意排放造成的 |
下列离子方程式正确的是
| A.硫酸铜溶液与足量氢氧化钡溶液混合:Ba2++SO42-=BaSO4↓ |
| B.AgCl悬浊液中加入硫化钠饱和溶液:2AgCl + S2-=Ag2S +2Cl- |
C.硫化钠的水解反应:S2-+H3O+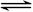 HS-+H2O HS-+H2O |
| D.用K37ClO3与浓盐酸制氯气:37ClO3-+6H++6Cl-=37Cl-+3Cl2↑+3H2O |
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g)  2XY3(g)△H=-92.6 kJ·mol-1
2XY3(g)△H=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
| X2 |
Y2 |
XY3 |
||
| ① |
1 |
3 |
0 |
放热 23.15 kJ |
| ② |
0.6 |
1.8 |
0.8 |
Q(Q>0) |
下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量Q为23.15kJ
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ