某温度下,在一密闭容器中发生如下可逆反应:2E(g)  F(g)+xG(g);△H<0。若起始时E浓度为a mol·L-1,F、G浓度均为0,达平衡时E浓度为0.5a mol·L-1;若E的起始浓度改为 2a mol·L-1,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是
F(g)+xG(g);△H<0。若起始时E浓度为a mol·L-1,F、G浓度均为0,达平衡时E浓度为0.5a mol·L-1;若E的起始浓度改为 2a mol·L-1,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是
| A.升高温度时,正反应速率加快、逆反应速率减慢 |
| B.若x=l,容器体积保持不变,新平衡下E的体积分数为50% |
| C.若x=2,容器体积保持不变,新平衡下F的平衡浓度大于0.5a mol·L-1 |
| D.若x=2,容器压强保持不变,新平衡下E的物质的量为a mol |
下列说法错误的是()
| A.分子式为C3H6Cl2的有机物有四种 |
| B.医疗上用硫酸钡作“钡餐”,是由于硫酸钡难溶于水 |
| C.用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应 |
| D.相同物质的量的2—甲基丁烷和2,2—二甲基丙烷中共用电子对数目相同 |
下列离子方程式正确的是()
| A.向次氯酸钙溶液中通入少量二氧化硫:Ca2++2ClO—+SO2+H2O=CaSO3↓+2HClO |
B.用Na2CO3溶液作洗涤剂:CO2-3+2H2O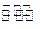 H2CO3+2OH— H2CO3+2OH— |
| C.用碳酸钠溶液吸收少量二氧化硫:2CO2-3+SO2+H2O=2HCO—3+SO2-3 |
D.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO—3+5I—+3H2O=3I2+6OH — — |
设NA表示阿伏加德罗常数的值。下列叙述正确的是()
| A.1mol乙醇与足量钠反应生成H2的分子数目为3NA |
| B.0.1molFe参加氧化还原反应,转移的电子数目一定是0.2NA |
| C.CO和N2互为等电子体,22.4L的CO气体与NA个N2所含的电子数相等 |
| D.在一定条件下,13.0g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.2NA |
下列表示物质结构的化学用语或模型图正确的是()
A.H2O2的电子式: |
B.O2-的结构示意图: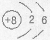 |
C.聚氯乙烯的结构简式: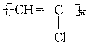 |
D.丙烷分子的球棍模型示意图: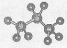 |
利用右图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑。下列说法正确的是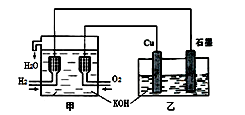
| A.乙中Cu电极的电极反应式是: 2Cu + 2OH-→ Cu2O+ H2O+ 2e- |
| B.甲中通入氢气的电极为正极 |
| C.乙中阴离子向石墨电极移动 |
| D.电路上通过0.5 mol电子,可制得0.5 mol Cu2O |