2,3-二氢呋喃是抗肿瘤药物的中间体,也用于电子化学品和香料中,可由丙烯为原料合成: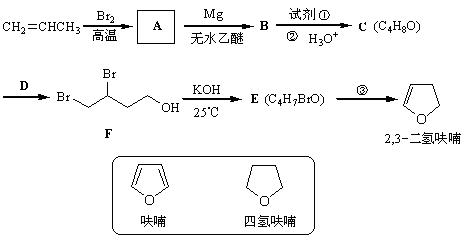
已知: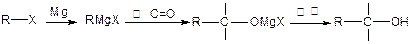
(1)写出A、E的结构简式: A ________________ E ________________。
(2)试剂①是___________,该步反应类型是 反应。
(3)反应③的条件是____________,该步还产生另一有机副产物:____________。
(4)写出满足下列条件的呋喃的一种同分异构体的结构简式 。
①没有支链,且一取代产物只有两种;②与银氨溶液不发生银镜反应;
(5)四氢呋喃还可以由化合物G (C4H9ClO)在氢氧化钠作用下制得,请写出该反应的方程式______ _____。
(6)化合物 是合成某些药物的中间体。试设计合理方案由化合物
是合成某些药物的中间体。试设计合理方案由化合物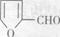 合成
合成 。提示:①合成过程中无机试剂任选;②
。提示:①合成过程中无机试剂任选;②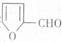 在400摄氏度金属氧化物条件下能发生脱羰基反应;③合成反应流程图表示方法示例如下:
在400摄氏度金属氧化物条件下能发生脱羰基反应;③合成反应流程图表示方法示例如下: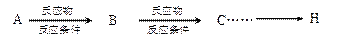
(6分)某石灰石样品中含有少量SiO2杂质。5.0g样品与50mL 2mol/L盐酸充分反应后,得到1064mL CO2(标准状况)。计算:
(1)石灰石样品中SiO2的质量分数为
(2)中和多余盐酸所需要1mol/L NaOH溶液的体积为 mL。
mL。
已知A、B、C、D、E是短周期中的5种非金属元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族;E的单质为黄色晶体,易溶于二硫化碳。
(1)请写出下列元素的元素符号
A:C:E:(各1分)
(2)画出 E的阴离子结构示意图:(1分)
E的阴离子结构示意图:(1分)
(3)A的单质和C的单质在一定条件下生成化合物X,用电子式表示X的形成过程;向X的水溶液中滴入酚酞溶液,会观察到
(4)将9克B的单质在足量的D的单质中燃烧,所 得气体通入1L
得气体通入1L  1mol·L-1
1mol·L-1
NaOH溶液中,完全吸收后,溶液中大量存在的溶质是,
且物质的量为(各2分)
Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、X与Y同周期,Y与Z同主族。Q与W可以按照原子个数比4∶1形成化合物甲,且甲分子中含有10个电子。Q与X形成化合物乙,乙可与Z的最高价氧化物的水化物按照物质的量之比2∶1反应形成盐丙。
(1)请写出甲的结构式。(2分)
(2)请写出Q和Y形成的既含极性键又含非极性键的共价化合物的化学式
(3)丙属于化合物(共价或离子),向少量丙溶液中加入浓NaOH溶液加热,反应的离子方程式是。
(1)带有2个单位正电荷的微粒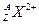 ,质量数A是137,中子数N
,质量数A是137,中子数N
是81,2.74g该微粒所含有的电子约为mol。
(2)某元素最高价氧化物的化学式是RO2,已知其气态氢化物中含氢25% 。
①计算R的相对原子质量为;
②写出R最高价氧化物对应的水化物的化学式.
28.下图中 A、B、C、D、E均为有机化合物。已知:C能跟NaHCO3发生反应,C和D的相对分子质量相等,且E为无支链的化合物。
根据上图回答问题:
(1)C分子中的官能团名称是 ______________;化合物B不能发生的反应是(填字母序号):
a 加成反应 b取代反应 c消去反应 d酯化反应 e水解反应 f 置换反应
(2)反应②的化学方程式是____________。
(3)试分析反应②加热的原因。
Ⅰ、。;
Ⅱ、。。
(4)A的结构简式是 __________________。
(5)同时符合下列三个条件的B的同分异构体的数目有个。
Ⅰ.含有间二取代苯环结构 Ⅱ.属于非芳香酸酯 Ⅲ.与 FeCl3溶液发生显色反应。
写出其中任意一个同分异构体的结构简式。
(6)常温下,将C溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
C物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| m |
0.1 |
0.1 |
pH=9 |
| n |
0.2 |
0.1 |
pH<7 |
从m组情况分析,所得混合溶液中由水电离出的c(OH-)=mol·L-1。
n组混合溶液中离子浓度由大到小的顺序是 ___________。