三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥型分子,键角102°,沸点-129°C;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式: 。
(2)NF3的沸点比NH3的沸点(-33°C)低得多的主要原因是 。
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为
。
(4)理论上HF、NaAlO2和NaCl按6∶1∶2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是 ,配位数为 。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
①在周期表中,最可能处于同一族的是 和 。
②T元素最可能是 (填“s”、“p”、“d”、“ds”等)区元素,位于 族。
若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为 ,其中心原子的杂化方式为 。
(8分)分别用一种试剂将下列物质中混入的少量杂质除去(括号内为混入的杂质)
| 物质 |
需加入的试剂 |
有关离子方程式 |
| FeSO4 (Fe2(SO4) 3) |
||
| Mg(Al) |
||
| CO2 (HCl) |
||
| SiO2(CaCO3) |
(7分)A、B、C、D、X均为中学化学常见的物质。它们之间存在如下图所示转化关系(图中反应条件略去)填写下列空白:
(1)若A为金属铝,B为氧化铁,写出反应A+B→C+D的一种用途
(2)若A为两性氢氧化物, B为NaOH溶液,写出反应A+B→C+D的离子方程式。
(3)若A为金属单质,B、C、D都是化合物,A与B发生的反应常用于刻制印刷电路板,该反应的离子方程式。
(4)若A、B、C为化合物,D、X为单质,A、B、C中肯定含有X元素的是
(12分)黄铜矿(主要成分为CuFeS2)是海洋矿物中的一种,它是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。请回答下列问题:
(1)利用黄铜矿冶炼铜的反应为8CuFeS2+21O2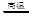 Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
①反应中被还原的元素是________(填元素符号),
②生成1 mol Fe2O3时转移电子的物质的量为________mol。
(2)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:
①用过量稀盐酸浸取炉渣,过滤。
②先将滤液氧化,再向其中加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
据以上信息回答下列问题:
A.①中过滤的目的是____________________,
B.②中将滤液氧化常常选用H2O2,其反应的离子方程式为____________________。
C.只能选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水,
①所选试剂为_
②证明炉渣中含有FeO的实验现象为
Fe(OH)2很不稳定,露置在空气中容易被氧化,Fe(OH)2被氧化的化学方程为:。为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时你觉得还需加入。
(2)除去蒸馏水中溶解的O2常采用的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是。
(4)检验Fe3+存在的最佳试剂是,现象是。
(5)写出Fe与H20在一定条件下反应的化学方程式。
某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。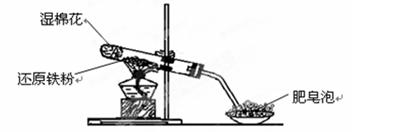
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为。
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许固体物质于试管中,并向试管中加稀硫酸得溶液B;
②取少量溶液B于试管中,滴加几滴KSCN溶液,结果溶液未变红色,说明硬质试管中固体物质的成分有:__________________。(填化学式)
(3)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按下图所示的操作,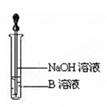
可观察到先生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请按顺序写出与上述现象相关的反应方程式:属于离子反应的只写离子方程式。①②
(4)一段时间后,该同学发现(2)中未变红的溶液变成红色,说明Fe2+ 具有性。由此可知,实验室中FeSO4溶液在保存时要加入少量铁粉,其原因是_________________。(用离子方程式表示)