对于平衡体系2SO2(g) + O2(g)  2SO3(g);ΔH<0.下列结论中正确的是
2SO3(g);ΔH<0.下列结论中正确的是
| A.若温度不变,将容器的体积增大一倍,此时的SO2浓度变为原来的0.48倍 |
| B.若平衡时SO2、O2的转化率相等,说明反应开始时,两者的物质的量之比为2:1 |
| C.若从平衡体系中分离出SO3,则有利于提高SO2的转化率和加快正反应速率 |
| D.平衡状态时SO2、O2、SO3的物质的量之比一定为2:1:2 |
下列说法正确的是
| A.增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大 |
| B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 |
| C.升温能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 |
| D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
在2A+B 3C+4D的反应中,下列用不同物质的变化表示该反应的速率最快的是
3C+4D的反应中,下列用不同物质的变化表示该反应的速率最快的是
A.v(A)=0.5mol·L-1·min-1 B.v(B)=0.3mol·L-1·min-1
C.v(C)=0.8mol·L-1·min-1 D.v(D)=1mol·L-1·min-1
右图为直流电源电解稀Na2SO4水溶液的装置,在电极a和b附近分别滴加石蕊溶液,通电后在a极收集到c mol气体,下列叙述正确的是( ) 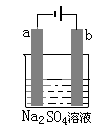
| A.若两极均为石墨电极,则消耗水为2c mol |
| B.若两极均为铜电极,则消耗水为2c mol |
| C.a电极附近呈红色,b电极附近呈蓝色 |
| D.电极逸出无味气体,另一电极逸出刺激性气味气体 |
下列有关金属腐蚀与防护的说法正确的是()
A.金属被腐蚀的本质是:M+nH2O=M(OH)n+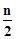 H2↑ H2↑ |
| B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 |
| D.产生气泡的速度甲比乙慢 |