下列有关表述正确的是
⑴-OH 与 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同
⑵sp2杂化轨道:
⑶Fe2+的离子结构示意图: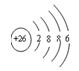
⑷CO2的分子模型示意图:
⑸丙烷的分子结构模型示意图:
⑹次氯酸的电子式为
⑺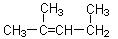 名称为1,3-二甲基―2―丁 烯
名称为1,3-二甲基―2―丁 烯
⑻熔化时NaHSO4的电离方程式为NaHSO4=Na++HSO4—
⑼乙炔的最简式 CH≡CH
| A.(1)(2)(4)(6) | B.(2)(3)(5) | C.(1)(4)(5)(8) | D.(1)(2)(5)(8) |
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2OΔH<0
2N2(g)+3H2OΔH<0
在恒容的密闭容器中,下列有关说法正确的是(
| A.平衡时,其他条件不变,升高温度可使该反应的平衡常数减小 |
| B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C.单位时间内消耗NO和N2的物质的量比为1:2时,反应没有达到平衡 |
| D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
已知充分燃烧a g乙炔(C2H2)气体时生成2 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧热的热化学方程式正确的是( )
| A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2b kJ / mol |
| B.C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) ΔH=-b kJ / mol |
| C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-4b kJ / mol |
| D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=b kJ / mol |
在温度和容积不变的容器中,一定条件下发生下列变化:H2(g)  2H(g)(气态氢原子)。ΔH >0。当容器中H2的浓度从0.1mol/L变为0.06mol/L时,需20秒,那么H2的浓度由0.06mol/L下降到0.036mol/l时需时间:()
2H(g)(气态氢原子)。ΔH >0。当容器中H2的浓度从0.1mol/L变为0.06mol/L时,需20秒,那么H2的浓度由0.06mol/L下降到0.036mol/l时需时间:()
| A.12秒 | B.无法判断 | C.大于12秒 | D.小于12秒 |
对可逆反应4NH3(g)+ 5O2(g)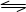 4NO(g)+ 6H2O(g),△H <0下列叙述正确的是()
4NO(g)+ 6H2O(g),△H <0下列叙述正确的是()
| A.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O) |
| B.若升高温度,逆向反应速率增加,正向反应速率减小 |
| C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 |
| D.达到化学平衡时,4υ正(O2)= 5υ逆(NO) |
下列反应中生成物总能量高于反应物总能量的是()
| A.碳酸钙受热分解 | B.乙醇燃烧 |
| C.铝粉与氧化铁粉末反应 | D.氧化钙溶于水 |