水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g) CO (g) +H2 (g) △H= +131.3 kJ•mol-1(······①
CO (g) +H2 (g) △H= +131.3 kJ•mol-1(······①
(1)实际工业生产中,向炭层间隔交替通入水蒸气和空气,其中通入空气的原因是由于该反应是吸热,导致炭层温度降低,须及时通入富氧空气促进炭层的燃烧放热:
C (s) + O2(g)= CO2 (g);△H = -393.5kJ·mo1-1 ······②
为保持生产的连续性,若不考虑其它热量的产生和损耗,则每间隔应通入的水蒸气和空气的体积比(同温同压)约为多少?(设空气中氧气的体积占1/5)
(2)一定温度下,三个容器中均进行着上述反应①,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。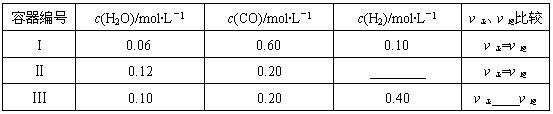
(3)生物乙醇可由淀粉或纤维素等生物质原料发酵获得。利用乙醇可进而获得合成气(CO、H2)。用乙醇生产合成气有如下两条路线:
a、水蒸气催化重整:CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g)
b、部分催化氧化:CH3CH2OH(g)+1/2O2(g)→3H2(g)+2CO(g)
某生物质能研究所准备利用乙醇得到的合成气合成一种生物汽油。乙醇各分一半按a、b两式反应。合成气合成生物汽油的反应为:2mCO+(2m+n)H2→2CmHn+2mH2O。假定合成的生物汽油中含有X、Y两种成分,且X、Y都是有8个碳原子的烃,X是苯的同系物,Y是烷烃。
①X的分子式为 ,Y的分子式为 。
②50吨质量分数为92%的乙醇经上述转化(假定各步转化率均为100%),则最终可获得X的质量为多少吨?
.在一定条件下,NO跟NH3可以发生反应生成N2和H2O,现有NO和NH3的混合物1mol ,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g.
(1)写出反应的化学方程式,并标出电子转移的方向和数目.
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少?
.将某温度下的KNO3溶液200g蒸发掉10g水恢复到原温度,或向其中加入10gKNO3固体均可使溶液达到饱和.试计算:
(1)该温度下KNO3的溶解度.
(2)原未饱和溶液中溶质的质量分数
在容积为2L的密闭容器中进行如下反应:A(g) + 2B(g)  3C(g)+nD(g), 开始时A为4 mol,B为6 mol;5 min末时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol/(L· min)。
3C(g)+nD(g), 开始时A为4 mol,B为6 mol;5 min末时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol/(L· min)。
计算: (1)5 min末A的物质的量浓度为
(2)前5 min内用B表示的化学反应速率v(B)为
(3)化学方程式中n值为
(4)此反应在四种不同情况下的反应速率分别为:
①v(A )="5" mol/( L·min )②v( B )="6" mol/( L·min )
③v(C)="4.5" mol/( L·min )④v(D )="8" mol/( L·min )
其中反应速率最快的是(填编号)
(8分)把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入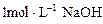 溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示。
溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示。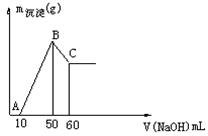
求:(1)合金中镁、铝各自的质量。
(2)盐酸的物质的量浓度。
(8分)实验室里常用氯化铵和足量熟石灰混合加热制取氨气。
(1)若需要500 ml (标准状况)氨气,至少需称取氯化铵的质量是多少?(用托盘天平称量)
(2)若将5000 ml (标准状况)氨气溶于水配成100 ml 溶液,则氨水中NH3的物质的量浓度是多少?( 不考虑NH3与水的反应)