CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
请回答下列问题:
(1)基态Cu原子的核外电子排布式为 ,H、N、O三种元素的电负性由大到小的顺序是 。
(2)SO2分子的空间构型为 ,与SnCl4互为等电子体的一种离子的化学式为 。
(3)乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
(4)②中所形成的配离子中含有的化学键类型有 。(填字母)
A 配位键 B 极性键 C 离子键 D 非极性键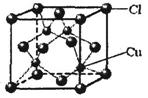
(5)CuCl的晶胞结构如上图所示,其中Cl原子的配位数为 。
A、B、C、D是常见不同主族的短周期元素,它们的原子序数逐渐增大,其中只有一种是金属元素,C元素原子最外层电子数是D元素原子最外层电子数的一半,B元素原子的最外层电子数比D的最外层电子数少两个。E、F也是短周期元素,E与D同主族,F与A同主族。
(1)写出F2E2的电子式。其中化学键类型为__________________。
(2)A 、 E 、 F 三种元素可形成一种离子化合物 R ,用惰性电极电解 R 的稀溶液的化学反应方程式为_________________________________;电解一段时间后,溶液 pH_____(填“增大”、“减小”或“不变”)。
(3)六种元素中的三种组成的易溶于水的酸性物质中,能促进水电离的物质M是(写化学式,写一个即可,下同),能抑制水电离的物质N是。25℃时,pH=a的M溶液中水电离出的H+浓度与pH=a的N溶液中水电离出的H+浓度之比为。
(4)甲、乙、丙分别是B、C、D三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应的产物不同。回答问题:
①向乙溶液中缓慢滴加过量的丙溶液过程中发生反应的离子方程式;
②向甲溶液中缓慢滴加过量的丙溶液,所观察到的实验现象为。
推断下列化合物的化学式:
⑴X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是_____;若XY2是共价化合物其电子式是______。
⑵第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其电子式为:_____。
⑶1mol某共价化合物,含有三种短周期元素的原子各1mol,且三种元素分别属于不同的周期,其质子总数为26mol,其中一种元素的最外层有7个电子,其分子的空间构型为______。
⑷某非金属X的最低负价为-2,它的最高价氧化物对应的水化物为强酸,则该元素的价电子构型是。
⑸X元素的最高正价和负价绝对值之差为6,Y元素的化合价为+1,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物在水溶液中能电离出电子层结构相同的离子,用电子式表示该化合物形成过程为:_________ 。
生产工程塑料PBT( )的重要原料G(1,4-丁二醇),可以通过下图三种不同的合成路线制备。又知B的所有原子处于同一平面。
)的重要原料G(1,4-丁二醇),可以通过下图三种不同的合成路线制备。又知B的所有原子处于同一平面。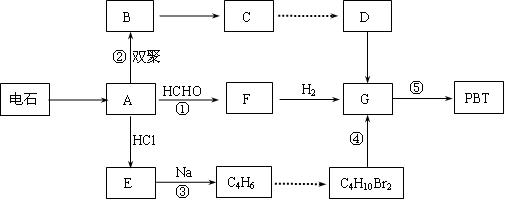
请你结合下列所给有关信息,回答问题。
Ⅰ.CH2=CH-CH=CH2与Br2的CCl4溶液发生1∶1加成可得到BrCH2-CH=CH-CH2Br和BrCH2-CHBr-CH=CH2二种产物。
 |
Ⅱ.2R-Cl+2Na R-R+2NaCl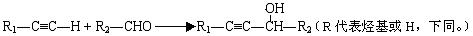
Ⅲ.
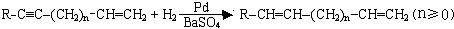 |
Ⅳ.
(1)写出E和F的结构简式:、。
(2)写出反应⑤的化学反应方程式:。
(3)请你设计出由B→C…→D的反应流程图(有机物用结构简式表示,必须注明反应条件)。
提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:
 |
|||||
 |
|||||
 |
|||||
B C…… G
有些食品的包装袋中有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰。
(1)生石灰的化学式为 ,它属于哪种类别的物质? ;
(2)生石灰可以用作干燥剂的理由是
(用化学方程式表示)
(3)生石灰还可以和哪些类别的物质发生化学反应?请举两例,并写出其化学方程式。
(4)小纸袋中的物质能否长期持续的做干燥剂?为什么?
(5)在你所了解的化学物质中还有哪些物质可以做干燥剂,请分类列举。
胶体是一类重要的分散系,你知道在化学实验室里怎样制备胶体吗?
(1)下列关于胶体的叙述中,不正确的是()
| A.胶体是一种混合物 |
| B.用丁达尔现象可区分Fe(OH)3胶体和CuSO4溶液 |
| C.用过滤器可以将胶体和溶液分开 |
| D.牛奶、鸡蛋白溶液、KMnO4溶液均属于胶体 |
(2)某同学往沸水中加入FeCl3溶液,得到的液体用光束照射时,没有看到光亮的通路,请你帮助他分析其中的原因。