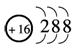水的电离过程为H2O H+ + OH─,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14,则下列叙述正确的是 ( )
H+ + OH─,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14,则下列叙述正确的是 ( )
| A.[H+]随温度的升高而降低 | B.水的电离过程是吸热的 |
| C.水的电离平衡常数与浓度、温度有关 | D.在35℃时,[H+] > [OH─] |
氯化碘(ICl)的化学性质跟Cl2相似,预计它与H2O反应的最初生成物是
| A.HI和HClO | B.HCl和HIO | C.HClO3和HIO | D.HCl和HI |
有关键能数据如表:
| 化学键 |
Si—O |
O=O |
Si—Si |
| 键能kJ·mol-1 |
X |
498、8 |
176 |
晶体硅在氧气中燃烧的热化学方程式:Si(s)+O2(g)═SiO2(s)△H= —989、2 kJ·mol-1,则表中X的值为( )
A、423、3 B、460 C、920 D、1165、2
下列离子方程式书写正确的是
| A.向碳酸氢钙溶液中加入足量氨水:Ca2++2HCO3-+2OH-="==" CaCO3↓+CO32-+2H2O |
| B.向KI与稀硫酸的混合溶液中通入氧气:4H++O2+4I-===2I2+2H2O |
| C.次氯酸钠溶液中通入二氧化硫气体:2ClO-+SO2+H2O=2HClO+SO32- |
D.硫化钠的水解反应:S2-+H3O+ HS-+H2O HS-+H2O |
设NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% |
| B.通常状况下,NA个CO2分子的体积大于22.4L |
| C.100mL 0.1mol/L 的H2SO4溶液中H+的个数是0.2NA |
| D.若1g N2含有m个分子,则NA=m/28 |
正确掌握好化学用语是学好化学的基础,下列有关表述正确的是
A.H、D、T互为同素异形体
B.氨气分子中的化学键为非极性共价键
C.NH4Cl的电子式为: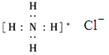
D.S2-的结构示意图为