丙二醇和其他无机原料合成环状化合物D。
(1)请在下列方框内填入合适的化合物的结构简式:
(2)C和水发生加成反应生成B的化学方程式;
(3)D和NaOH水溶液共热的化学方程式;
(4)C属于______类化合物,名称为______。
在稀氨水中存在平衡:NH3+H2O NH
NH +OH-,如进行下列操作,则NH3、NH
+OH-,如进行下列操作,则NH3、NH 、H+、OH-浓度如何变化?请用“增大”“减小”“不变”填写。
、H+、OH-浓度如何变化?请用“增大”“减小”“不变”填写。
(1)通适量HCl气体时,c (NH3),c (H+)。
(2)加入少量NaOH固体时,c(NH ),c (OH-)。
),c (OH-)。
(3)加入NH4Cl晶体时,c (NH ),c (OH-)。
),c (OH-)。
(14分)
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
(1)A基态原子中能量最高的电子,其电子云在空间有个方向,原子轨道呈形。
(2)某同学根据上述信息,所画的B电子排布图如图
违背了原理。
(3)F位于族区,其基态原子有种运动状态。
(4)CD3 中心原子的杂化方式为,用价层电子对互斥理论推测其分子空间构型为。
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为,该单质晶体中原子的堆积方式为四种基本堆积方式中的。若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为______g·cm-3(用字母表示)。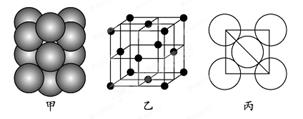
(12分)
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E的+1价阳离子的核外有3层电子且各层均处于全满状态。
(1)E元素基态原子的核外电子排布式为___________________。
(2)B、C、D三种元素的第一电离能由小到大的顺序为________(填元素符号)。其原因是_______________。
(3)已知D、E能形成晶胞结构如图所示的两种化合物,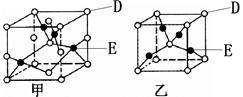
则化学式:甲为____________________,乙为______________________;
(4)(每空1分)B2A4是石油炼制的重要产物之一 。B2A4分子中B原子轨道的杂化类型为________;1 mol B2A2分子中含________mol σ键。
(共10分)根据已学知识,请你回答下列问题:
(1)含有8个质子,10个中子的原子的化学符号__________。
(2)最外层电子排布为4s24p1的原子的核电荷数为__________。
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是_________。
(4)根据VSEPR模型,H3O+的分子立体结构为:,SO2的立体结构为:。
(5)周期表中最活泼的非金属元素原子的轨道表示式为__________。
(6)(每空2分)三氯化铁常温下为固体,熔点282°C,沸点315°,在300°C以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为________。
(7)(每空2分)某元素核外有三个电子层,最外层电子数是核外电子总数的1/6,写出该元素原子的电子排布式是__________。
原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的2倍;b和d的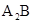 型氢化物均为
型氢化物均为 型分子,c的
型分子,c的 价离子比e的
价离子比e的 价离子少8个电子。回答下列问题;
价离子少8个电子。回答下列问题;
(1)元素a为,c为。
(2)这些元素的单质或由它们形成的 型化合物中,其晶体类型属于原子晶体的是,离子晶体的是,金属晶体的是,分子晶体的是(每空填一种)。
型化合物中,其晶体类型属于原子晶体的是,离子晶体的是,金属晶体的是,分子晶体的是(每空填一种)。
(3)(每空2分)由这些元素形成的三原子分子中,分子的空间结构属于直线的是,非直线的是(各写2种)。