1 L某溶液中含有的离子如下表: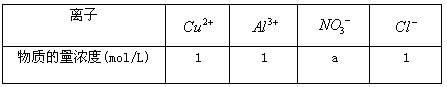
用惰性电极电解该溶液,当电路中有3 mol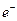 通过时(忽略电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是
通过时(忽略电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是
| A.电解后溶液的pH="0" | B.a=3 |
C.阳极生成1.5 mol  |
D.阴极析出的金属是铜与铝 |
以下是分离乙酸乙酯、乙酸、乙醇的混合物的流程图,图中圆括号内填入适当的试剂,方括号内填入适当的分离方法,方框内是有关物质的名称。下列说法正确的是()
| A.a为NaOH溶液,①为蒸馏 | B.②、③均为蒸馏,①为分液 |
| C.②为分液,C中含有醋酸钠 | D.b可以是硫酸,也可以是盐酸 |
下列有机反应属于同一反应类型的是()
| A.乙醇制乙醛、乙醇和乙酸制乙酸乙酯 | B.苯制溴苯、乙烯制乙醇 |
| C.甲烷制一氯甲烷、苯制硝基苯 | D.苯制环己烷、乙酸乙酯水解 |
设NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A.标准状况下,4.48L氦气和重氢气(D2)的混合物中所含中子数为0.4NA |
| B.常温下,0.1molCl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
C.10.6gNa2CO3固体中,所含CO 的数目为0.1NA 的数目为0.1NA |
| D.足量铜与0.1L18.4mol·L-1”浓硫酸反应,生成SO2的分子数一定小于0.92NA |
将Na2O2、HCl和Al2O3一起溶于一定量的水中,完全反应后,测得所得溶液中只含有Na+、AlO2-、Cl- (不考虑AlO2-的水解和H2O的电离),则Na2O2、HCl、Al2O3的物质的量之比不可能是()
| A.2∶2∶1 | B.3∶3∶1 | C.3∶4∶1 | D.4∶6∶1 |
下列离子或分子组中能大量共存,且满足相应要求的是()
| 选项 |
离子 |
要求 |
| A |
K+、NO3-、Cl-、HS- |
c(K+)<c(Cl-) |
| B |
Fe3+、NO3-、SO32-、Cl- |
逐滴滴加盐酸立即有气体产生 |
| C |
Na+、HCO3-、Mg2+、SO42- |
逐滴滴加氨水立即有沉淀产生 |
| D |
NH4+、Al3+、SO42-、CH3COOH |
滴加NaOH浓溶液立刻有气体产生 |