(12分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2 6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,转移 mol电子。
6SO2+Fe3O4,氧化产物为 ,若有3 mol FeS2参加反应,转移 mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为
。
(3)与明矾相似,硫酸铁也可用作净水剂,其原理为 (用离子方程表示)
(4)①钢铁的电化腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。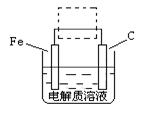
②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式 。
(5)铁红是一种红色颜料,其成分是Fe2O.3将一定量的铁红溶于160ml5 mol·L—1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为 。
已知:5种短周期元素A、B、C、D、E的原子序数依次增大。A原子只有1个电子;元素B的最外层电子数比内层电子数多3;元素C是海水中质量分数最大的元素;D的单质可在B的单质中点燃条件下燃烧生成一种离子化合物;元素E与C形成的化合物EC2可用于自来水的消毒。请回答下列问题:
(1)在周期表中,元素B位于第_____周期____族;B与D形成的离子化合物的电子式为________。
(2)C、D形成的简单离子的半径大小关系为(用离子符号表示)________________。
(3)B、D元素形成的化合物可与水反应生成一种沉淀和一种气体,试写出反应的化学方程式:________________________________________________________________。
(4)A、B形成的化合物可与B、C形成的化合物在一定条件下反应生成一种无毒、参与大气循环的气体,试写出其中的一个化学方程式:______________________________。
(5)写出E的单质与水反应的离子方程式:___________________________________。
已知X、Y、Z、W四种元素分别是元素周期表中三个连续短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子的最外层电子数之和。Y与X形成的分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z两种元素的元素符号为:X._____、Z ____。
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为___,它的共价键属于_______(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为______;含有极性共价键和非极性共价键的化合物的电子式为________。
(3)由X、Y、Z所形成的常见离子化合物是(写化学式)_______,该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为:___________________;
X与W形成的化合物与水反应时,水作________(填“氧化剂”或“还原剂”)。
(4)用电子式表示W与Z形成W2Z化合物的过程:___________________。
CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1
2H2(g)+O2(g)===2H2O(g) △H2=﹣483.6kJ·mol-1
C(s)+H2O(g)===CO(g)+H2(g) △H3= +131.3kJ·mol-1
则反应CO(g)+H2(g)+O2(g)===H2O(g)+CO2(g)的△H=。
标准状况下的煤炭气(CO、H2)336L与氧气反应生成CO2和H2O,反应过程中转移mol电子。
(2)熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO+H2-4e-+2CO32-===3CO2+H2O;则该电池的正极反应式是:。
(3)密闭容器中充有1 mol CO与2mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)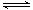 CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。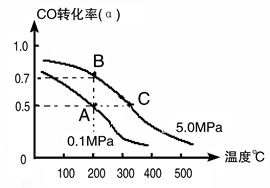
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=;此时在B点时容器的体积VB10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tC tA(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高CO转化率可采取的措施是。(写出两点即可)
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图。
1)从图中可以看出,D跟B形成的离子化合物的化学式为
2)该离子化合物晶体的密度为ag·cm-3,则晶胞的体积是(只要求列出算式)。
晶体具有规则的几何外形,晶体中最基本的重复单位被称为晶胞。中学教材中NaCl晶体结构即为NaCl的一个晶胞。已知FexO晶体的晶胞结构为NaCl型,由于晶体缺陷,x<1。实验测得FexO晶体的密度为5.71g/cm3,晶胞的边长为4.28×10-5m。NaCl的晶胞如图所示:
(1)求FexO中X的具体数值(精确至0.01)为,晶体中Fe元素只有+2和+3价,则在Fe2+、Fe3+的总数中,Fe2+所占分数(用小数表示,精确至0.001)为
(2)此晶体的化学式为
(3)晶体中与O2-距离最近且相等的Fe2+或Fe3+所围成的几何构形是 (4)晶体中,Fe离子间最近距离为cm
(4)晶体中,Fe离子间最近距离为cm