对实验Ⅰ~Ⅳ的实验现象预测正确的是 A 实验Ⅰ:液体分层,下层呈无色
A 实验Ⅰ:液体分层,下层呈无色
B 实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C 实验Ⅲ:试管中溶液颜色不变为红色
D 实验Ⅳ:放置一段时间后,饱和CUSO4溶液中出现蓝色晶体
某同学用下列装置制备并检验Cl2的性质: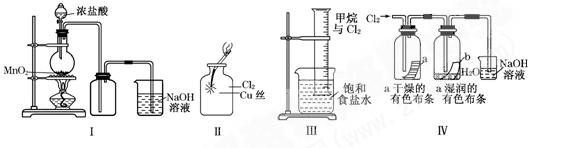
下列说法正确的是()
| A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完 |
| B.Ⅱ图中:生成蓝色的烟 |
| C.Ⅲ图中:量筒中发生了加成反应 |
D.Ⅳ 图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生 成 成 |
取一定质量含Cu、Cu2O、CuO的固体混合物,将其分成两等份并进行下列转化: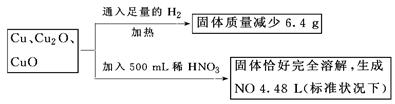
则转化过程中所加稀HNO3的物质的量浓度为( )
| A.4.4 mol·L-1 | B.3.6 mol·L-1 |
| C.4.0 mol·L-1 | D.3.2 mol·L-1 |
甲在常温时为离子晶体,由X、Y两种元素组成,在甲中Xm+和Yn–的电子结构相同,甲、乙、丙、丁、戊、己之间有如下反应关系:
 ①甲+H2O H2↑+乙+丙↑ ②H2 + 丙丁(气体)
①甲+H2O H2↑+乙+丙↑ ②H2 + 丙丁(气体)
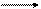 ③乙+丙甲+戊+H2O ④戊+丁甲+己(酸性)
③乙+丙甲+戊+H2O ④戊+丁甲+己(酸性)
甲、戊、己依次是()
| A.NaCl、NaClO、HClO | B.Na2S、Na2SO3、H2SO3 |
| C.CaCl2、Ca(ClO)2、HClO | D.K2S、K2SO3、H2SO4 |
相同质量的铜片分别与过量的体积相同的浓硝酸、稀硝酸反应。二者比较,相等的是()
①铜片消耗完所需时间; ②反应生成的气体体积(标准状况);
③反应中氧化剂得到的电子总数; ④反应后溶液中铜离子的浓度
| A.①③ | B.②④ | C.③④ | D.只有① |
有四组同族元素的物质,在101.3 kPa时测定它们的沸点(℃  )如下表所示:
)如下表所示:
| 第一组 |
He |
-268.8 |
(a) |
-249.5 |
Ar |
-185.8 |
Kr |
-151.7 |
| 第二组 |
F2 |
-187.0 |
Cl2 |
-33.6 |
(b) |
58.7 |
I2 |
184.0 |
| 第三组 |
(c) |
19.4 |
HCl |
-84.0 |
HBr |
-67.0 |
HI |
-35.3 |
| 第四组 |
H2O |
100.0 |
H2S |
-60.2 |
(d) |
-42.0 |
H2Te |
-1.8 |
下列各项中正确的是()
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第二组物质只表现氧化性,不表现还原性
C.第三组物质中C的沸点最高,是因为C分子内存在氢键
D.第四组中各化合物的稳定性顺序为:H2O>H2S> H2Se>H2Te