能在溶液中大量共存的一组离子是
| A.NH4+、Ag+、PO43-、Cl- | B.Fe3+、H+、I-、HCO3- |
| C.K+、Na+、NO3-、MnO4- | D.Al3+、Mg2+、SO42-、CO32- |
电子数相等的微粒叫做等电子体,下列各组微粒属于等电子体是
A CO和CO2 B NO和NO2
C CH4和NH3 D CO2和SO2
从某微粒的原子结构示意图反映出
| A.质子数和中子数 |
| B.中子数和电子数 |
| C.核电荷数和核外电子层排布的电子数 |
| D.质量数和核外电子层排布的电子数 |
不同元素的原子(包括离子)
| A.质子数一定不等 | B.中子数一定不等 |
| C.质量数一定不等 | D.核外电子数一定不等 |
提出元素周期律并绘制了第一个元素周期表的科学家是
| A.戴维 | B.阿伏加德罗 | C.门捷列夫 | D.道尔顿 |
对于可逆反应:2AB3(g) 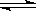 A2(g) + 3B2(g)△H>0,下列图像正确的是
A2(g) + 3B2(g)△H>0,下列图像正确的是
(其中AB3%是平衡时质量分数)