图中A、B、C、D、E、F、G均为有机化合物。
根据上图回答问题。
(1)D的化学名称是 。
(2)反应③的化学方程式是 。
(3)B的分子式是 。A的结构式是 。
反应①的反应类型是 。
(4)符合下列3个条件的B的同分异构体数目有 个。
①含有邻二取代苯环结构②与B有相同官能团③不与FeCl3溶液发生显色反应
写出其中任意一种同分异构体的结构简式 。
(5)G是重要的工业原料,用化学方程式表示G的一种重要工业用途: 。
汽油不仅是重要的燃料,而且是重要的化工原料。它既可以裂解得到气态化工原料如乙烯等,还可以在催化剂催化下改变分子结构,由链烃变成芳香烃,如已烷变成苯,庚烷变成甲苯,这个变化叫异构化。请根据以汽油为原料的下列衍变关系,回答下列问题: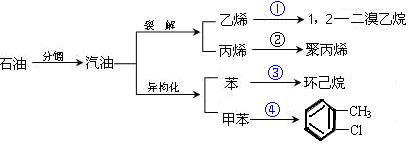
(1)写出反应②和③的化学方程式
________________________________;___________________________________
(2)①④的反应类型分别是_____________、_________________
(3)四氟乙烯(CF2=CF2)在一定条件下发生聚合反应,生成的聚四氟乙烯可做“不粘锅” 炊具的内涂层。下列叙述正确的是
| A.聚四氟乙烯中不含碳碳双键,在高温时容易燃烧 |
| B.聚四氟乙烯是高分子化合物 |
| C.聚四氟乙烯的化学性质很稳定,正常使用时几乎不会发生化学变化 |
| D.由于氟是最活泼的非金属元素,故四氟乙烯不会发生任何化学变化 |
E.取等质量的乙烯和聚乙烯,完全燃烧,生成的CO2和H2O的物质的量分别相等
F.四氟乙烯和聚四氟乙烯都属于纯净物
下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。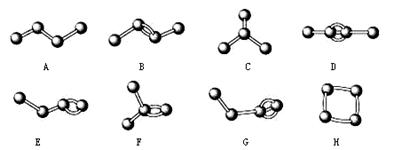
(1)图中与甲烷互为同系物的是(填编号)
(2)上图中互为同分异构体的是:B与;D与。(填编号)
[Ⅰ] 将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:
3A(g) +B(g) 2C(g)+2D(g),
反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s 内正反应的化学反应速率为;
(2)反应前A的物质的量浓度是;
(3)平衡后,生成物D的浓度为;
[Ⅱ] 某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生2 SO2+ O2 2 SO3反应。几分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为______________。
2 SO3反应。几分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为______________。
已知乳酸的结构简式为 。试回答:
。试回答:
(1)乳酸分子中含有________和_________两种官能团(写名称);
(2)乳酸与足量金属钠反应的化学方程式为
___________________________________________________________________;
(3)乳酸与Na2CO3溶液反应的化学方程式为
___________________________________________________________________;
全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%。
⑴地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ、H2O(l)=2H+(aq)+1/2O2(g)+2e-△H=+284kJ/mol
Ⅱ、CO2(g)+C5(s)+2H+(aq)=2C3+(s)△H=+396kJ/mol
Ⅲ、12C3+(s)+12e-=C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=-1200kJ/mol
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式。
⑵有效地开发利用CO2可以降低大气中CO2的含量,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的恒容密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol 。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol 。测得CO2和CH3OH(g)的浓度随时间变化如图所示。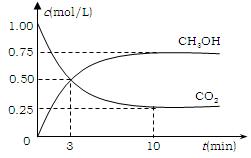
①从反应开始到平衡,氢气的平均反应速率
v(H2)=___________mol/(L·min);
②CO2的转化率=;
③该反应的平衡常数为(保留小数点后2位);
④ 下列措施中能使平衡体系中
下列措施中能使平衡体系中
n(CH3OH)/n(CO2)增大的是___________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出去 | D.再充入1molCO2和3molH2 |