验室常用浓盐酸与二氧化锰反应来制取氯气,反应的化学方程式4HCl+MnO2="=" MnCl2+2H2O+Cl2↑现用密度为1.1 9g/cm3、质量分数为36.5%的浓盐酸与二氧化锰反应,生成的氯气在标准状况下的体积为5.6L。计算:
(1)浓盐酸中HCl的物质的量浓度。
(2)需要消耗二氧化锰多少克?
(3)被氧化的HCl的物质的量是多少?
雷鸣电闪是日常生活中司空见惯的现象。设某次雷电中,两块云团间的电势差约为109 V,放电电量约为30 C。在闪电过程中,空气中有氮气和氧气直接化合,已知每摩尔氮气和氧气化合时要吸收180.74 kJ的能量,闪电时有1/1000的能量用于这一反应。试求:
(1)此次闪电所产生NO的物质的量为多少?
(2)此次雷雨闪电的生成物相当于给土壤施了多少千克尿素?
(10分)含CuSO4和H2SO4的混合溶液200 mL,其中CuSO4物质的量浓度为1 mol·L-1,H2SO4物质的量浓度为0.5 mol·L-1,若用此溶液配成0.2 mol·L-1 CuSO4和2 mol·L-1 H2SO4的混合溶液,试求:
(1)所得溶液的体积是多少毫升?
(2)需加入密度为1.84 g·cm-3,质量分数为98%的浓硫酸多少毫升?
2,4,5三氯苯酚和氯乙酸反应可制造除草剂2,4,5三氯苯氧乙酸。某生产该除草剂的工厂曾在一次事故中泄漏出一种有毒的二NF749英,简称TCDD。有关物质的结构式如下:
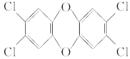
2,4,5三氯苯酚氯乙酸 2,4,5三氯苯氧乙酸 TCDD
请写出:
(1)生成2,4,5三氯苯氧乙酸反应的化学方程式。
(2)由2,4,5三氯苯酚生成TCDD反应的化学方程式。
2个空格不要动模块综合测试
(14分)利用天然气合成氨的工艺流程示意图如下:
依据上述流程,完成下列填空。
(1)天然气脱硫时的化学方程式是________________。
(2)n mol CH4经一次转化后产生CO 0.9n mol,产生H2________mol。(用含n的代数式表示)
(3)K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是__________。(多选扣分)
a.相似相溶原理
b.勒夏特列原理
c.酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于__________ (写出CO2的一种重要用途)。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
如果1 mol金属钠的质量为23 g,密度ρ=0.97 g·cm-3,则每个钠原子的半径约为多少?(设钠为紧密堆积的球体)