在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)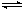 CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如下图所示。下列说法错误的是
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如下图所示。下列说法错误的是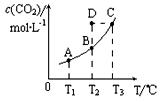
A.反应CO(g)+H2O(g)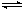 CO2(g)+H2(g)的△H>0 CO2(g)+H2(g)的△H>0 |
| B.在T2时,若反应进行到状态D,则一定有v正<v逆 |
| C.平衡状态A与C相比,平衡状态A的c(CO)小 |
| D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
按图装置持续通入气体x,并在管口P处点燃,实验结果使澄清石灰水变浑浊,则X、Y可能是( )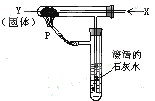
①H2和NaHCO3 ②CO和Na2CO3
③CO和CuO④H2和Fe2O3
| A.①② | B.①③ | C.②③ | D.③④ |
等物质的量的N2,O2,CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压)这时混合气体中N2,O2,CO2的物质的量之比为()
| A.3:4:1 | B.3:3:2 | C.6:7:3 | D.6:9:0 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B.含有0.1 mol/L Ca2+的溶液中:Na+、K+、CO32-、Cl- |
| C.遇酚酞变红的溶液中:K+、Na+、CH3COO-、Br- |
| D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NH4+ |
有五瓶失去标签的溶液,它们分别为:①Ba(NO3)2 ②KCl ③NaOH ④CuSO4 ⑤Na2SO4 ,如果不用其他任何试剂(包括试纸),用最简便的方法将它们一一鉴别开来,则在下列的鉴别顺序中,最合理的是( )
| A.③④①⑤② | B.④②③⑤① | C.①⑤③④② | D.④③①⑤② |
将钠、镁、铝各0.3 mol分别放入100 mL 1 mol/L的盐酸中,同温同压下产生的气体体积比是( )
| A.1∶2∶3 | B.3∶1∶1 | C.6∶3∶2 | D.1∶1∶1 |