某同学设计测定镀锌铁皮镀锌层厚度的实验方案:将单侧面积为S、质量为m1的镀锌
铁皮放入6mol·L-1的盐酸中,当气泡产生的速率显著减少时,取出铁片,用水冲洗,烘
干后称量,得到质量为m2,下列说法不正确的是
| A.当铁片产生气泡速度减慢时,立即取出铁片,不冲洗就用酒精灯加热烘干,铁片可能继续和残留的盐酸反应,导致结果偏高 |
| B.实验过程中产生气泡的速率是先慢,然后逐渐加快,再显著减慢,这是微电池和温度共同影响的结果 |
| C.锌和铁在酸溶液中形成原电池,外电路中电流从铁流向锌 |
D.设锌镀层厚度为h,锌的密度为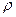 ,那么 ,那么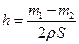 |
用惰性电极电解下列溶液,电解一段时间后,电解质溶液的pH上升的是:
| A.饱和NaCl溶液 | B.AgNO3 | C.CuCl2 | D.饱和NaOH溶液 |
PH值等于2的两种溶液A和B,分别加水稀释1000倍,其PH值与所加水的体积变化趋势示意图如图所示,则下列结论正确的是: C
C
| A.等体积pH=2的两种酸中和NaOH的能力酸A比酸B强 |
| B.A为弱酸,B为强酸 |
| C.酸B的摩尔浓度比酸A大 |
| D.A比B易电离 |
下列离子方程式中正确的是:
| A.少量SO2通入NaOH溶液中:OH-+SO2→HSO3- |
| B.H2S通入氯水中:S2-+Cl2 →S↓+2Cl- |
| C.二氧化氮溶于水:3NO2+H2O →2H++2NO3-+NO↑ |
| D.少量NaHSO4与过量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH- →BaSO4↓+2H2O |
对气体反应:mA+nB eC温度(T)、压强(P)、时间(t)与生成物的体积百分数C%的关系图,下列结论正确的是:
eC温度(T)、压强(P)、时间(t)与生成物的体积百分数C%的关系图,下列结论正确的是: AD
AD
| A.正反应是放热反应 | B.m+n<e |
| C.正反应是吸热反应 | D.m+n>e |
室温下xL pH=a的盐酸溶液和yL pH=b的电离度为α的氨水恰好完全中和,则x/y的值为:
| A.1 | B.10-14-a-b /α | C.10a+b-14/α | D.10a-b/α |