已知C(石墨)、H2和CO的燃烧热分别为393.5kJ/mol、285.8kJ/mol和282.8kJ/mol。现有H2和CO组成的混合气体56.0L(标准状况),经充分燃烧后,放出总热量为710.0kJ,并生成液态水。下列热化学方程式或描述中,正确的是( )
| A.2CO(g) + O2(g) = 2CO2(g); △H= +282.8kJ/mol |
| B.2H2(g) + O2(g) = 2H2O(g); △H= -571.6kJ/mol |
| C.C(石墨,s) + 1/2O2(g) =" CO(g);" △H= -110.7kJ/mol |
| D.燃烧前混合气体中,H2的体积分数为40% |
核内中子数为N的R2+离子,质量数为A,则n g它的氧化物中所含质子的物质的量是
A. (A-N+8)mol (A-N+8)mol |
B. (A-N+10)mol (A-N+10)mol |
| C.(A-N+2)mol | D.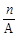 (A-N+6)mol (A-N+6)mol |
检验氯化氢气体中是否混有 Cl2,可采用的方法是
| A.用干燥的蓝色石蕊试纸 | B.用干燥有色布条 |
| C.将气体通入硝酸银溶液 | D.用湿润的淀粉碘化钾试纸 |
下列有关碱金属的说法中,正确的是
| A.金属锂应保存在煤油中 |
| B.金属钾着火应用泡沫灭火剂更好 |
| C.它们都能在空气里燃烧生成M2O(M表示碱金属) |
| D.碱金属单质随着核电荷数的递增与水反应的剧烈程度逐渐加剧直至燃烧爆炸 |
我国的“神舟五号”载人飞船已发射成功, “嫦娥”探月工程也已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的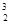 He,每百吨
He,每百吨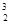 He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以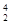 He的形式存在。下列说法正确的是
He的形式存在。下列说法正确的是
A.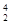 He原子核内含有4个质子 He原子核内含有4个质子 |
B.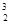 He和 He和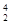 He互为同 位素 He互为同 位素 |
C.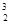 He原子核内含有3个中子 He原子核内含有3个中子 |
D.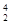 He具有较强的金属性 He具有较强的金属性 |
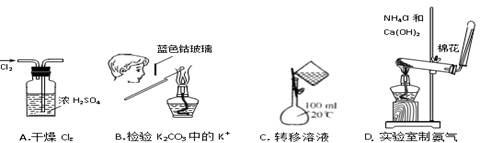
下图所示的实验操作,不能达到相应目的的是