对于放热反应2H2(g)+O2(g) = 2H2O(l),下列说法正确的是( )
| A.产物H2O所具有的总能量高于反应物H2和O2所具有的总能量 |
| B.反应物H2和O2所具有的总能量高于产物H2O所具有的总能量 |
| C.反应物H2和O2所具有的总能量等于产物H2O所具有的总能量 |
| D.反应物H2和O2比产物H2O稳定 |
在容积相同的A、B两个密闭容器中,分别充入2molSO2和1molO2,使它们在相同温度下发生反应:2SO2+O2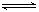 2SO3并达到平衡.在反应过程中,若A容器保持体积不变,B容器保持压强不变,当 A 中的 SO2 的转化率为 25% 时,则 B 容器中 SO2 的转化率应是
2SO3并达到平衡.在反应过程中,若A容器保持体积不变,B容器保持压强不变,当 A 中的 SO2 的转化率为 25% 时,则 B 容器中 SO2 的转化率应是
A.25% B.>25% C.<25% D.12.5%
在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度)。下列结论正确的是
2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度)。下列结论正确的是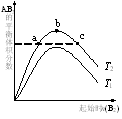
A.a、c两点A2的转化率相等
B.正反应一定是吸热反应,且T2>T1
C.b点时,平衡体系中A、B原子数之比为1:3
D.向a点的平衡体系中加入A2,可达到b点的平衡状态
把6molA和5molB两气体通入容积为4L的密闭容器中,一定条件下反应:3A(气)+B(气) 2C(气)+xD(气);△H<0,5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1。下列说法中正确的是
2C(气)+xD(气);△H<0,5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1。下列说法中正确的是
| A.降低平衡体系的温度,逆返应速率变小,正反应速率增大,平衡正向移动 |
| B.恒温下达到平衡的标志是C和D的生成速率相等 |
| C.A的平均反应速率为0.15mol·(L·min)-1 |
| D.B的转化率为25% |
下列说法或表示方法正确的是
| A.反应物的总能量低于生成物的总能量时,该反应一定不能发生 |
| B.在10l kPa、25 ℃时,1 g H2完全燃烧生成气态水,放出120.9 kJ的热量,则氢气的燃烧热为241.8 kJ/mol |
C.已知:2SO2 (g) + O2 (g)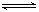 2SO3 (g) ;△H =-98.3 kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量 2SO3 (g) ;△H =-98.3 kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量 |
| D.由石墨比金刚石稳定可知:C(金刚石,s)= C(石墨,s) ;△H<0 |
在3L密闭容器中充入2molSO2和一定量O2,反应生成SO3气体,当进行到6min时,测得n(SO2)=0.4mol,若反应只进行到3min时,容器内n(SO2)为
| A.小于1.2mol | B.0.8mol | C.大于0.8mol | D.小于0.8mol |