下图是元素周期表的前四周期的结构,请回答
| A |
|
|
|||||||||||||||
| |
|
|
|
B |
C |
D |
|
|
|||||||||
| E |
|
F |
|
|
|
G |
|
||||||||||
| |
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
⑴请写出各元素的元素符号:A 、B 、C 、D 、
⑵请写出C元素单质的结构式
⑶E、D两种元素可形成一种原子个数比为1:1的化合物M,请写出M的电子式 ,指出化合物M中的化学键类型 。
⑷E、F、G三种元素的最高价氧化物对应的水化物可以两两反应,请写出反应的离子方程式:
E+F
E+G
F+G
⑸H的一种氢氧化物不稳定,很容易被氧气氧化,请写出该反应的化学方程式:
高锰酸钾(KMnO4)和过氧化氢(H2O2)是两种典型的氧化剂。
(1)H2O2的结构式为________________。
(2)下列物质中能使酸性KMnO4溶液褪色的是________(填选项字母)。
| A.臭碱(Na2S) | B.小苏打(NaHCO3) |
| C.水玻璃(Na2SiO3) | D.酒精(C2H5OH) |
(3)高锰酸钾、双氧水、活性炭常用于饮用水的处理,但三者联合作用时必须有先后顺序。①在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e-→2H++O2↑
还原反应:MnO4-+5e-+8H+→Mn2++4H2O
写出该氧化还原反应的离子方程式_____________________________。
②在处理饮用水时,活性炭应在高锰酸钾反应结束后投加,否则会发生反应:KMnO4+C+H2O→nO2+X+K2CO3(未配平),其中X的化学式为________。
请按要求填空:
I.现有:①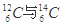 、② O2与O3、③ 正丁烷与异丁烷、④ 金刚石与石墨、⑤ 冰与水、⑥ 乙醇与二甲醚。请用序号填写对应的分类:
、② O2与O3、③ 正丁烷与异丁烷、④ 金刚石与石墨、⑤ 冰与水、⑥ 乙醇与二甲醚。请用序号填写对应的分类:
(1)互为同位素的是( );
(2)互为同素异形体的是( );
(3)互为同分异构体的是( );
(4)属于同一化合物的是( )
II.现有以下物质:①NaCl晶体 ②液态(纯)H2SO4 ③液态的(纯)醋酸 ④汞(金属) ⑤纯蔗糖(C12H22O11) ⑥酒精(C2H5OH) ⑦熔化的KNO3,请回答下列问题(用序号):
(1)以上物质中能导电的是( ),
(2)以上物质中属于电解质的是( ),
(3)以上物质中属于非电解质的是( ),
(4)以上物质中溶于水后形成的水溶液能导电的是( )。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式。
(2)浓硫酸的作用是:①;②。
(3)饱和碳酸钠溶液的主要作用是。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是。
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。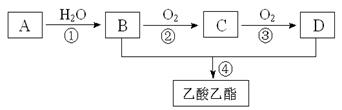
回答下列问题:
(1)写出A的电子式;
(2)B、D分子中的官能团名称分别是、;
(3)写出下列反应的反应类型:①④;
(4)写出A→B反应的化学方程式:
A→B;
(5)已知0.1mol液态的B完全燃烧生成液态水时放出136.68kJ热量,该反应的热化学方程式为。
如图示是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等。回答: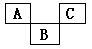
(1)写出元素符号:A ;
(2)C的离子结构示意图:;B的最高价氧化物对应水化物的化学式为__________。
(3)A、B、C三种元素的气态氢化物中最稳定的是(填氢化物化学式)