下列反应的离子方程式正确的是( )
| A.用FeCl3溶液与铜反应制作印刷电路板:Cu+Fe3+==Cu2++Fe2+ |
| B.碳酸氢镁溶液中加入过量石灰水: Mg2++2HCO3-+Ca2++2OH-==CaCO3↓+2H2O+MgCO3↓ |
C.用惰性电极电解AlCl3溶液:2Cl-+2H2O 2OH-+Cl2↑+H2↑ 2OH-+Cl2↑+H2↑ |
| D.硫酸铜溶液中通入硫化氢:Cu2++H2S==CuS↓+2H+ |
一定条件下,在密闭容器里进行如下可逆反应:S2Cl2(橙黄色液体)+Cl2(气)  2SCl2(鲜红色液体)DH=-61.16kJ·mol-1。下列说法正确的是
2SCl2(鲜红色液体)DH=-61.16kJ·mol-1。下列说法正确的是
| A.单位时间里生成n mol S2Cl2的同时也生成n mol SCl2 |
| B.达到平衡时,若升高温度,压强不变,氯气转化率增大 |
| C.达到平衡时,单位时间里消耗n mol S2Cl2的同时也生成n molCl2 |
| D.加入氯气,平衡向正反应方向移动,氯气的转化率一定升高 |
对于0.1mol·L-1 Na2SO3溶液,正确的是
| A.升高温度,溶液的pH降低 |
| B.c(Na+)=2c(SO32-)+ c(HSO3-)+ c(H2SO3) |
| C.c(Na+)+c(H+)=2 c(SO32-)+ 2c(HSO3-)+ c(OH-) |
| D.加入少量NaOH固体,c(SO32-)与c(Na+)均增大 |
下面有关电化学的图示,完全正确的是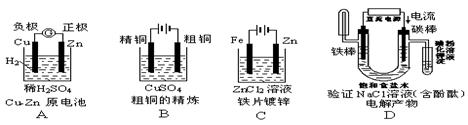
下图为某化学反应速率—时间图,在t1时刻升高温度或增大压强,都符合下图所示变化的反应是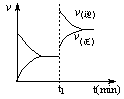
A.2SO2 (g)+O2 (g) 2SO3 (g)DH<0 2SO3 (g)DH<0 |
B.4NH3 (g)+5O2 (g)  4NO(g)+6H2O (g)DH<0 4NO(g)+6H2O (g)DH<0 |
C.H2 (g)+I2 (g)  2HI (g)DH>0 2HI (g)DH>0 |
D.C (s)+H2O (g)  CO (g)+H2 (g)DH>0 CO (g)+H2 (g)DH>0 |
在恒容的密闭容器中,下列反应分别达到平衡后,有关说法正确的是
A.2HI(g) H2(g)+I2(g);DH>0,若降低温度,颜色加深,压强增大 H2(g)+I2(g);DH>0,若降低温度,颜色加深,压强增大 |
B.2NO2(g) N2O4(g);DH<0,充入氩气,压强增大,红棕色变浅 N2O4(g);DH<0,充入氩气,压强增大,红棕色变浅 |
C.2SO2(g)+O2(g) 2SO3(g);DH<0,升温后,平均相对分子质量减小 2SO3(g);DH<0,升温后,平均相对分子质量减小 |
D.3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g);DH<0,加入铁后,Fe3O4将增加 Fe3O4(s)+4H2(g);DH<0,加入铁后,Fe3O4将增加 |