茉莉花是一首脍炙人口的民歌。茉莉花香气的成份有多种,乙酸苯甲酯
(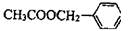 ),是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇
),是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇
为原料进行人工合成。一种合成路线如下: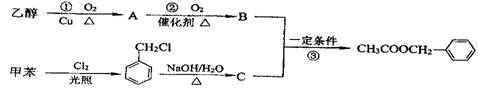
(1)C的结构简式为 。
(2)写出反应①的化学方程式: 。
(3)反应③的化学方程式: 。其反应类型为 。
(4)反应 (填序号)原子的理论利用率为100%,符合绿色化学的要求。
(5)写出符合下列条件的乙酸苯甲酯一种同分异构体:①含苯环结构 ②具有酯的结构: 。
(6)指出乙醇的两个重要用途 、 。
如图:A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为。
(2)B中Sn极的电极反应式为。Sn极附近溶液的pH值(填“变大”、“变小”、“不变”)
(3)C中被腐蚀的金属是,该电极电极反应式为,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为。
(6分)有一包白色粉末状混合物,可能含有Na2CO3、NaCl、CaCO3、CuSO4、KCl、Na2SO4、MgCl2、KNO3中的某几种,现进行如下实验:
①将混合物溶于水,得到无色透明溶液。
②取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,再加上稀硝酸,沉淀不溶解,在另一份中加入NaOH溶液,也产生白色沉淀。
根据上述实验现象回答:
(1)原混合物中肯定没有__________________________。
(2)原混合物中肯定有____________________________。
(3)不能确定是否含有____________________________。
同温同压下,同体积的N2和SO2分子数之比为,物质的量之比为,原子总数之比为,摩尔质量之比为,质量之比为,密度之比为。
有A、B、C三瓶失去标签的无色溶液:K2CO3、BaCl2、Na2SO4。首先不用其他试剂就可鉴别出的是(写化学式),如要继续鉴别余下两种,还需要选用的试剂是(写名称),现象分别为。
对于混合物的分离或提纯,常采用的方法有:①过滤、②蒸发、③蒸馏、④萃取、⑤加热分解等。下列各组混和物的分离或提纯应采用什么方法?(填序号)
(1)提取碘水中的碘 ___________
(2)除去食盐溶液中的水 ___________
(3)淡化海水
(4)KCl中含有KClO3