已知Co2O3 在酸性溶液中易被还原成Co2+、Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是()
| A.3Cl2 +6FeI2 = 2FeCl3 +4FeI3 |
| B.Cl2 + 2FeI2 = FeCl2 + I2 |
| C.Co2O3 + 6HCl = CoCl3 +Cl2↑+ 3H2O |
| D.2Fe3+ + 2I- = 2Fe2+ +I2 |
在一定条件下,KClO3与I2发生下列反应:2KClO3+I2=2KIO3 +Cl2 推断正确的是()
A. 该反应属于置换反应
B. 氧化性I2>KClO3
C 还原性KClO3>I2
D. 还原剂为I2,氧化剂为KClO3
在泡沫橡胶的制造中,要利用下列反应放出的氧:2H2O2=2H2O +O2↑其中,H2O2()
| A.是氧化剂 |
| B.是还原剂 |
| C.既是氧化剂又是还原剂 |
| D.既不是氧化剂又不是还原剂 |
按金属活动性顺序由前到后考虑,下列说法中正确的是( )
| A.单质的还原性逐渐减弱 |
| B.原子的失电子能力逐渐增强 |
| C.对应离子的氧化性逐渐增强 |
| D.对应离子的得电子能力逐渐减弱 |
下列反应中水做氧化剂的是()
| A.SO3 +H2O=H2SO4 |
| B.Na + 2H2O=2NaOH +H2 |
C.2H2 +O2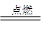 2H2O 2H2O |
| D.2F2 +2H2O=4HF +O2 |