Ⅰ⑴用14.2g无水硫酸钠配制成500 ml溶液,其物质的量浓度为 ▲ mol/L。
⑵若从上述溶液中取出10 ml,则这10 ml 溶液的物质的量浓度为 ▲ mol/L,含溶质的质量为 ▲ g。
⑶若将上述10 ml 溶液用水稀释到100 ml,所得溶液中Na+的物质的量浓度为 ▲ mol/L;若将稀释后溶液中的SO42-全部沉淀下来,至少需要加入0.1 mol/L的BaCL2溶液
▲ ml 。
Ⅱ现有36%的醋酸(CH3COOH),密度为1.04g/ml.,
欲配制0.1 mol/L的醋酸250 ml,需要取用36%的醋酸 ▲ ml。
需要使用的实验仪器有烧杯、 ▲ 、 ▲ 、 ▲ 、 ▲ ,
若配制时仅有其中一步操作(如图所示)有错误,其他操作全部正确,则所配醋酸的浓度 ▲ (填“正确”、“偏大”或“偏小”)。
▲ (填“正确”、“偏大”或“偏小”)。
某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题
(1)第1步:灼烧。操作是将足量海带放到灼烧成灰烬。
A.试管 B.瓷坩埚
(2)第2步:Iˉ溶液的获取。操作是将灰烬转到烧杯中,加适量蒸馏水,用充分搅拌,煮沸,。(填操作名称)
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用。(填代号)新制氯水 B.H2O2 C.KMnO4溶液
理由是。
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
| ① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响;) |
| ② |
粗颗粒 |
|||
| ③ |
||||
| ④ |
298 |
(2)实验①中CO2质量随时间变化的关系见右图: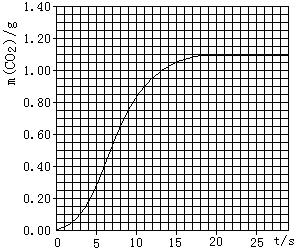
依据反应方程式CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在6s-11s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程,结果保留两位小数)。
实验室用如图所示的装置制取乙酸乙酯.
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法是:,然后轻轻振荡试管,使之混合均匀。
(2)装置中通蒸气的导管_________________________,目的是_______________。
(3)浓硫酸的作用是①___________;②___________.
(4)饱和Na2CO3溶液的作用是①________________________;②_____________________;
③_____________________________。
(5)生成的乙酸乙酯的化学方程式。
(6)若实验中温度过高,使反应温度达到140℃左右时,副反应的主要有机产物是_____________(填物质名称).
(16分)实验室可利用乙二醇、铜或铜的化合物制备乙二醛,右图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出)。试回答:
(1)两套装置中的A、B处都需加热,A处用水浴加热,B处用加热,A处用水浴加热的主要优点是
(2)若按甲装置进行实验,B管处装铜粉,则通入A管的X是,B中反应的化学方程式为。
(3)若按乙装置进行实验,则B管中应装,B中反应的化学方程式为。
(4)实验结束后,取C试管中的溶液滴入新制备的银氨溶液中并采用水浴加热可观察到有银镜生成,写出该过程的化学方程式。
(5)实验完成时先打开D处的铁夹,再撤去酒精灯,试说明这样做的目的是。
(共15分)I(1)为比较Fe3+ 和Cu2+ 对H2O2分解的催化效果,甲、乙两位同学分别设计了如图所示的实验。
甲、乙两同学可通过观察,定性比较得出结论。观察两同学的方案,你认为(填“甲”或“乙”)更合理。理由是。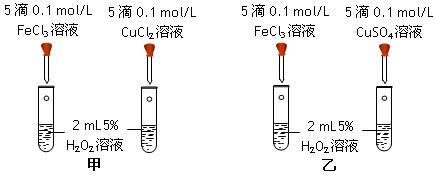
(2) 丙同学另外设计了如下实验验证过氧化氢酶对H2O2分解的作用(新鲜鸡肝片中含有过氧化氢酶):
①在试管A中加入3%的双氧水5 mL,再加入新鲜的鸡肝片1 g,有气体产生;
②在试管B中加入3%的双氧水5 mL,再加入煮熟的鸡肝片1 g,无气体产生;
③在试管C中加入3%的双氧水3 mL和10%的H2SO42 mL,再加入新鲜的鸡肝片1 g,无气体产生。
由上述实验得到的结论是
_______________________________________________________________________,
_______________________________________________________________________。
写出①中产生气体的化学方程式:_____________________________________。